(2013?红桥区二模)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,E是大气污染物且为红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.A、B含同一种元素.(某些产物可能略去)
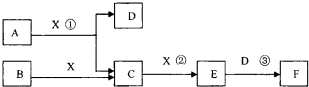
请回答下列问题:
(l)B的电子式为
.写出A与X反应的化学方程式
.
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是
①③④
①③④
(填序号)
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
(4)在常温下,向V
1L pH=a的A溶液中加入V
2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v
1和v
2的关系为V
1<
<
V
2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(写出一种情况即可).




 ,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2
,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2 ;4NH3+5O2
;4NH3+5O2

 (2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( )
(2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( ) (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.