
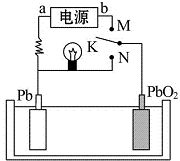
| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
分析 K与N相接时,为原电池反应,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电解质溶液中阳离子向正极移动,阴离子向负极移动,K与M连接时,为电解池装置,电解池中的Pb为阴极连接电源的负极,阳极是PbO2,结合电极方程式解答该题.
解答 解:A.K与N相接时是原电池,Pb做负极,Pb电极的反应式为Pb-2e-+SO42-=PbSO4,故A错误;
B.K与N相接时是原电池,阴离子向负极移动,则SO42-向Pb电极迁移,故B错误;
C.K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的a为负极,故C正确;
D.K与M连接时,装置是电解池,阳极是PbO2,电解方程式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,溶液中氢离子浓度增大,则pH减小,故D错误.
故选C.
点评 本题考查了原电池原理,侧重于学生的分析能力的考查,根据元素化合价变化确定正负极,再结合阴阳离子的移动方向、氢离子浓度的变化来分析解答,难度中等.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 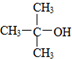 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 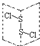 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
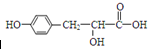 的说法中,正确的是( )
的说法中,正确的是( )| A. | 在核磁共振氢谱中有五组吸收峰 | |
| B. | 与 互为同分异构体 互为同分异构体 | |
| C. | 1mol 该有机物与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 可以发生取代反应、加成反应、消去反应和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有电子得失 | B. | 凡是能电离出H+的化合物均属于酸 | ||
| C. | 离子反应不一定是氧化还原反应 | D. | 置换反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是复分解反应 | |
| B. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | 生成2 mol ClO2时转移的电子数为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com