
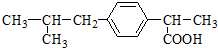
| A. | 该物质属于不饱和烃 | B. | 该物质的分子式为C13H20O2 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质属于芳香烃 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:多选题
| A. | H2SO4的酸性比HClO3酸性强 | |
| B. | Fe在纯氧中燃烧生成Fe3O4,Fe在氯气中燃烧生成FeCl3 | |
| C. | 在HClO中,元素化合价氯为+1价,氧为-2价 | |
| D. | O2为无色无味气体,Cl2为黄绿色有刺激性气味的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2投入水中 | B. | 铜片投入到FeCl3溶液中 | ||
| C. | NaHCO3溶液和NaOH溶液混合 | D. | 过量氨水加入到AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 除去乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液 | |
| C. | 用燃烧的方法鉴别甲烷与乙炔 | |
| D. | 用溴水鉴别苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
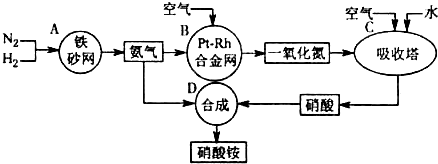
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
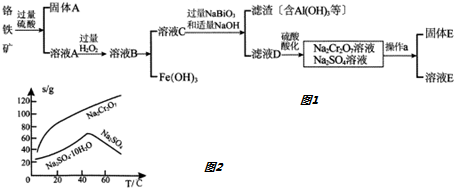

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com