

| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜在干燥的空气中和在潮湿的空气中存在的形态相同 |
| B、相同质量的铜分别与足量的氯气、硫完全反应,失去的电子数相同 |
| C、相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的量相同 |
| D、相同质量的铜分别与足量的稀硝酸、浓硝酸完全反应,生成气体的物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
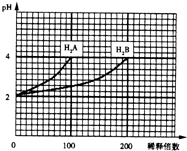 常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A、H2A为二元弱酸 |
| B、PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) |
| D、Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中:c(HB)+c(B-)=0.05mol/L |
| B、混合溶液中:c(OH-)+c(B-)-c(H+)=0.04mol/L |
| C、该NaB溶液中:c(H+)+c(HB)=1.0×10-6mol/L |
| D、该NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
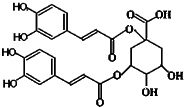 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com