
���� ��1�������Ʊ��������ֵ�ԭ���Լ����ϵ�ʹ��ע��������з�����
��2����������̼��������С��ԭ��ؽ��н��
��� �⣺��1������ԭ�ϲ���Ҫʹ��ʯ��ʯ���մɣ��������ڽ��⣬������ɰ�ɫ��Ⱦ�����Կ������ƽ������Ͽ��Է��Ρ���ɫ��Ⱦ�����ʴ�Ϊ���մɣ��������ƽ������ϣ�
��2��������ʴ��Ϊ��ѧ��ʴ�͵绯ѧ��ʴ�������ĵ绯ѧ��ʴ�Ǹ����������̼��������Сԭ��ص��µĸ�ʴ����������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Fe-2e-=Fe2+��
�ʴ�Ϊ��ԭ��أ�Fe-2e-=Fe2+��
���� ������������Ŀ�����ֵ���Ϣ�Բ��Ͻ��з���֪ʶ�Ŀ��飬����Ĺؼ��ǶԳ������ϵ���ʶ���ѶȲ���


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ�п��ܴ�������Fe2+��Cl?��NO3?��Na+ | |
| B�� | ��ɫ��Һ�п��ܴ�������Mg2+��NH4+��Cl?��SO42- | |
| C�� | ǿ������Һ�п��ܴ�������NH4+��K+��Cl?��SO42? | |
| D�� | ������Һ�п��ܴ�������Fe3+��K+��I?��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ζ�����������Һʱ����ƿ����ȡ25.00mL������������Һ | |
| B�� | ����Ͳ�����ˮ���ռ��Ƶõ��������Ϊ50.28 mL | |
| C�� | ����ֻ250 mL������ƿ����0.1 mol•L-1 500 mL��NaOH��Һ | |
| D�� | ��������ƽ��ȡ2.50 g���������ȳ��ʧˮ������������0.90 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
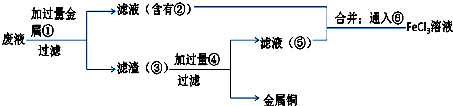
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com