
| A. | 相同温度下,0.1 mol•L-1NH4Cl溶液比0.1 mol•L-1NH4HSO4溶液含有的[NH4+]更大 | |
| B. | 将0.1 mol•L-1硫酸溶液从常温加热至100℃,溶液的pH保持不变 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在蒸发皿中加热蒸发(低于400℃)FeCl3溶液,可以得到FeCl3固体 |
分析 A.硫酸氢铵溶液中,氢离子抑制了铵根离子的水解;
B.根据溶液的pH=-lgc(H+)分析;
C.浓硫酸溶于水会放出大量热,导致放出热量增大;
D.氯化氢具有挥发性,铁离子水解生成氢氧化铁,所以最终得到的是氧化铁.
解答 解:A.由于硫酸氢铵溶液的氢离子抑制了铵根离子的水解,则相同温度下,0.1 mol•L-1NH4Cl溶液比0.1 mol•L-1NH4HSO4溶液含有的[NH4+]小,故A错误;
B.加热过程中溶液中氢离子浓度基本不变,而溶液的pH=-lgc(H+),所以硫酸溶液的pH不变,故B正确;
C.稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,由于浓硫酸溶于水会放出大量热,所以该反应放出的热量大于57.3 kJ,故C错误;
D.氯化铁水解生成氢氧化铁和氯化氢,加热过程中促进氯化氢挥发,从而促进氯化铁水解,最后蒸干时得到氢氧化铁固体,灼烧时氢氧化铁固体分解生成氧化铁,所以最后得到的固体是氧化铁,故D错误;
故选B.
点评 本题考查了盐的水解原理,题目难度中等,明确盐的水解原理及其影响为解答关键,C为易错点,注意中和反应中必须为稀的强酸与稀的强碱溶液,不能用浓硫酸或弱酸、弱碱.


科目:高中化学 来源: 题型:选择题
| A. | 小苏打的化学式:NaHCO3 | |
| B. | 镁离子的结构示意图: | |
| C. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| D. | NaOH的电离方程式:NaOH=Na++O2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
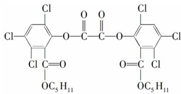
| A. | 它属于芳香族化合物 | |
| B. | 它的分子式为C26H24O8Cl6 | |
| C. | 它难溶于水 | |
| D. | 1 mol这种物质最多可以跟6mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 为防止中秋月饼等富脂食品被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 对废旧电池进行回收处理主要为了防止重金属污染水源 | |
| D. | 大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在整个18列元素中,第1列的元素种类最多 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第1列元素均为金属元素 | |
| D. | 第9列元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com