
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
方案一 方案二
方案二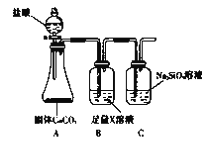
(1)根据方案一装置回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:_________________。
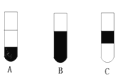
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与下图吻合的是________。(填代号)
Ⅲ.装置③中的现象是____________________。
(2)根据方案二装置回答以下问题:
Ⅰ.方案二验证元素非金属性递变的理论依据是:__________________________。
Ⅱ.B装置的作用是_________________,X是_______________________。
Ⅲ.能说明碳元素和硅元素非金属性强弱的实验现象是______________________。
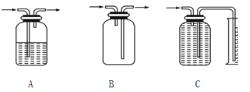
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”。分析下图中广口瓶组合装置的用途;
A____________;B_____________;C____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O A 溶液变蓝色 元素的非金属性越强,最高价氧化物对应水化物的酸性越强;酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强制弱) 吸收CO2中的HCl 饱和NaHCO3溶液 C中有白色沉淀产生 洗气 收集密度比空气小的气体 C测量气体体积
MnCl2+Cl2↑+H2O A 溶液变蓝色 元素的非金属性越强,最高价氧化物对应水化物的酸性越强;酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强制弱) 吸收CO2中的HCl 饱和NaHCO3溶液 C中有白色沉淀产生 洗气 收集密度比空气小的气体 C测量气体体积
【解析】
(1)二氧化锰和浓盐酸加热生成二氯化锰和氯气;氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,单质溴易溶于四氯化碳中,四氯化碳密度比水大,据此分析现象;氯气把碘离子置换成单质碘,碘遇淀粉变蓝;
(2)根据信息知道:方案二根据元素非金属性与对应最高价含氧酸之间的关系完成C、Si两种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;Ⅱ氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;碳酸酸性强于硅酸,硅酸为不溶性沉淀;
(3)根据装置特点和所盛试剂分析所起作用。
(1)Ⅰ、二氧化锰和浓盐酸加热生成二氯化锰和氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O;
MnCl2+Cl2↑+H2O;
Ⅱ、氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,Cl2+2Br-=Br2+2Cl-,单质溴易溶于四氯化碳中,四氯化碳密度比水大,故碘的四氯化碳在下层,出现的现象与右图吻合的是A,故答案为:A;
Ⅲ、氯气把碘离子置换成单质碘,Cl2+I-=I2+2Cl-,碘遇淀粉变蓝,故看到的现象为溶液变蓝色,故答案为:溶液变蓝色;
(2)Ⅰ、根据题干信息可知方案二根据元素非金属性与对应最高价含氧酸之间的关系,设计了同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则元素的非金属性越强,依据强酸制弱酸来设计反应,故答案为:元素的非金属性越强,最高价氧化物对应水化物的酸性越强;酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强制弱);
Ⅱ、氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液,故答案为:吸收CO2中的HCl;饱和NaHCO3溶液;
Ⅲ、C中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,反应的离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,故答案为:C中有白色沉淀产生;
(3)A长进短出,属于洗气装置,B没有试剂,短进长出,属于向下排空气法收集气体,C广口瓶和量筒相连属于量气装置,故答案为:A洗气; B 收集密度比空气小的气体; C测量气体体积。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4) 3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1) 经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:_____。
(2) 经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色) +I2。
CuI↓(白色) +I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
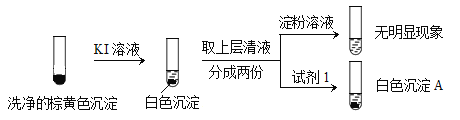
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu2+和SO32的理由是___________。
(3) 已知:Al2(SO4) 3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH) 3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
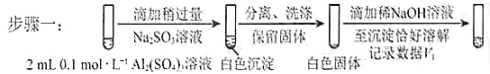
步骤二:_____________(按上图形式呈现) 。
(4) 根据实验,亚硫酸盐的性质有______。盐溶液间反应的多样性与___有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
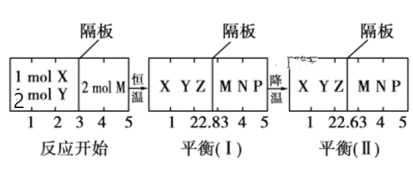
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达到平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达到平衡(Ⅰ)时,X的转化率为5/11
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
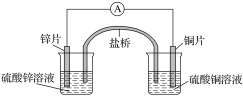
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增大CO的浓度B.降低温度C.升高温度D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积固定的密闭容器中通入2.0 mol SO2、1.2molO2,发生反应2SO2(g) + O2(g)![]() 2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
A.2SO2(g) + O2(g) ![]() 2SO3(s) ΔH< -198kJ·mol-1
2SO3(s) ΔH< -198kJ·mol-1
B.增加反应物的量不能改变上述反应的ΔH
C.充分反应后,放出的热量小于198 kJ
D.若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________,密度______。(填“变大”“变小”或“不变”)。
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )
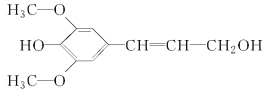
A.芥子醇的分子式是C11H12O4
B.芥子醇分子中所有碳原子不可能在同一平面
C.芥子醇能与FeCl3溶液发生显色反应
D.1 mol芥子醇与足量溴水发生加成或取代反应时共消耗3 mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com