
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
分析 A.钡离子与硫酸氢铵反应生成硫酸钡沉淀;
B.通KSCN溶液变红色的溶液中存在铁离子,四种离子之间不反应,都不与铁离子反应;
C.该溶液中存在大量氢离子,氢离子与次氯酸根离子反应;
D.与铝反应产生大量氢气的溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应.
解答 解:A.NH4HSO4溶液中存在硫酸根离子,Ba2+与硫酸根离子反应生成硫酸钡沉淀,在溶液中不能大量共存,故A错误;
B.通KSCN溶液变红色的溶液中存在铁离子,NH4+、Al3+、SO42-、Cl-之间不反应,都不与铁离子反应,在溶液中能够大量共存,故B正确;
C.该溶液呈酸性,溶液中存在大量氢离子,ClO-与氢离子反应,在溶液中不能大量共存,故C错误;
D.与铝反应产生大量氢气的溶液呈酸性或碱性,CO32-与氢离子反应,在酸性溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+)/c(NH3•H2O)先增大再减小 | |
| C. | 当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用排水法收集二氧化氮气体 | |
| B. | 浓硝酸存放于棕色广口试剂瓶中 | |
| C. | 配制氯化亚铁溶液时,将氯化亚铁固体溶解在蒸馏水中加少量盐酸即可 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
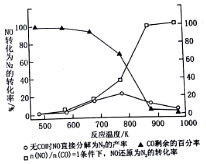 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
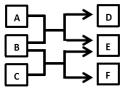 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸 | |
| D. | 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com