
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
分析 I、(1)根据二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol写出热化学方程式:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1455kJ/mol①
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol②
将②×6-①可得2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)据此求出△H;
反应的平衡常数的表达式K=$\frac{生成物的平衡浓度的幂之积}{反应物的平衡浓度的幂之积}$;
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,即二氧化碳,据此写出化学方程式;
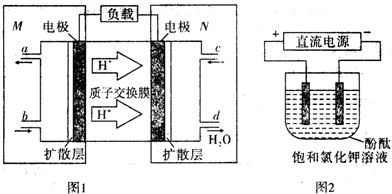
(3)①由于氢离子移向N极,故N极为正极,M极为负极,故可燃物CH3OCH3放电生成二氧化碳,结合酸性环境来配平;
②该燃料电池的能量利用率为80%,即电池转移电子的80%=电解中转移电子,结合电子转移守恒计算.
II、(1)当一个量在平衡之前在变化,而后来不变了,则这个量可以作为平衡的标志;
(2)①根据反应中NO2(g)和SO2(g)的起始浓度分别为0.1mol/L,设在10min达到平衡时,NO2浓度的该变量为x,根据三段式结合平衡常数来分析;
②由于容器体积相同,故丙中反应物的浓度大于甲,据此分析反应速率;由于是气体体积不变的反应,故甲和丙为等效平衡,而乙相当于是向甲容器中加入NO2,据此分析.
解答 解:I、(1)根据二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol可知热化学方程式:
CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1455kJ/mol①
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol②
将②×6-①可得2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=(-285.8kJ/mol)×6-(-1455kJ/mol)=-259.8kJ•mol-1;
反应的平衡常数的表达式K=$\frac{生成物的平衡浓度的幂之积}{反应物的平衡浓度的幂之积}$=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
故答案为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1;$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,即二氧化碳,故化学方程式为:3CO+3H2=CH3OCH3+CO2,故答案为:3CO+3H2=CH3OCH3+CO2;
(3)①由氢离子的移动方向可知,M区为负极,发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+,故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;
②用惰性电极,电解饱和KCl总的电极反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,pH值变为13时,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.5L=0.05mol,
CH3OCH3~12e-~12OH-
46g 12mol
x×80% 0.05mol,
解得x=0.24g,
故答案为:0.24.
故答案为:0.24g;
II、(1)a.由于反应是气体体积不变的反应,且全部是气体,故体系内混合气体的密度一直保持不变,故不能作为平衡的标志,故a错误;
b.反应中v(NO2)正=v(SO3)正一直存在,而只有平衡时才有v(SO3)正=v(SO3)逆,故只有平衡时才有v(NO2)正=v(SO3)逆,故当v(NO2)正=v(SO3)逆时
,反应达平衡,故b正确;
c.由于反应是气体体积不变的反应,故容器内气体的总物质的量一直不变,则总压强一直保持不变,故不能作为反应达平衡的标志,故c错误;
d.在反应未平衡前,NO的消耗和生成速率不同,故NO体积分数会改变,当NO的体积分数不变时,说明反应达平衡,故d正确.
故选bd.
(2)①根据反应中NO2(g)和SO2(g)的起始浓度分别为0.1mol/L,设在10min达到平衡时,NO2浓度的该变量为x,根据三段式可知:
NO2(g)+SO2(g)?SO3(g)+NO(g)
初始(mol/L):0.1 0.1 0 0
△C:x x x x
平衡:0.1-x 0.1-x x x
根据平衡常数为$\frac{9}{4}$可知:$\frac{9}{4}$=$\frac{{x}^{2}}{(0.1-x)^{2}}$ 解得x=0.06mol/L.
则平均速率v(NO2)=$\frac{0.06mol/L}{10min}$=0.006mol/(L•min),故答案为:0.006mol/(L•min);
②由于容器体积相同,且反应为气体体积不变的反应,故按照等比加料,达到的是等效平衡,故甲和丙为等效平衡,即丙中所达的平衡状态和甲相同,而由于丙中反应物的浓度大于甲,故反应速率比甲快,到达平衡的时间比10min短;由于甲和丙为等效平衡,故甲、丙中SO2(g)的转化率相等,而乙相当于是向甲容器中加入NO2,据故SO2的转化率大于甲,故三个容器中的转化率的关系为a=c<b.故答案为:<;a=c<b.
点评 本题综合考查了热化学方程式的书写、燃料电池和反应速率的计算、化学平衡等问题,综合性较强,是高考的常见题型,应注意掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与Fe、Br2混合 | B. | 氯乙烷和NaOH溶液共热 | ||
| C. | 溴乙烷和NaOH的乙醇溶液共热 | D. | 乙烯和溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在离原子核越近的区域运动的电子,能量越低 | |
| C. | 1869年俄国化学家门捷列夫经研究提出了元素周期律,并列出了第一张元素周期表 | |
| D. | 因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
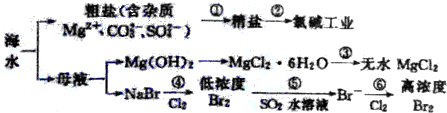
| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )
科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵易溶于水 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com