
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。A为由两种元素组成的固体,含非金属质量分数为39.13%;D、E、L均为无色气体,E和L难溶于水;F为常见金属;G、I、J焰色反应显黄色;M为有颜色的固体。
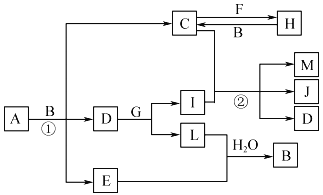
请回答下列问题:
(1)E的化学式为___________________。
(2)G的电子式为___________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:_______________________________。
【答案】 NO ![]() FeC3+8HNO3=Fe(NO3)3+3CO2↑+5NO↑+4H2O 2Fe3++3CO32-+3H2O==2Fe(OH)3↓+3CO2↑
FeC3+8HNO3=Fe(NO3)3+3CO2↑+5NO↑+4H2O 2Fe3++3CO32-+3H2O==2Fe(OH)3↓+3CO2↑
【解析】G、I、J焰色反应显黄色,含有钠元素,D、E、L均为无色气体,E和L难溶于水,因此G可能是过氧化钠,D是二氧化碳,I是氢氧化钠,L是氧气,E是NO,B是硝酸,M为有颜色的固体,M可能是氢氧化铁,F为常见金属,则F是铁,C是硝酸铁,H是硝酸亚铁,A为由两种元素组成的固体,含非金属质量分数为39.13%,A是由C和Fe两种元素形成的,原子数之比是![]() ,因此A的化学式为FeC3。
,因此A的化学式为FeC3。
(1)E的化学式为NO。(2)过氧化钠的电子式为![]() 。(3)根据以上分析可知反应①的化学方程式为FeC3+8HNO3=Fe(NO3)3+3CO2↑+5NO↑+4H2O。(4)反应②的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑。
。(3)根据以上分析可知反应①的化学方程式为FeC3+8HNO3=Fe(NO3)3+3CO2↑+5NO↑+4H2O。(4)反应②的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑。


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式磷酸钙[Ca10(PO4)6(OH)2],工业上叫羟基磷灰石或羟磷灰石,是人的牙齿中比较坚硬的物质,在水中有微弱的溶解,这是牙齿损坏的主要原因。氟磷酸钙也称氟磷灰石,它的化学式为Ca10(PO4)6F2,是牙表面牙釉的主要成分。
回答下列问题:
(1)基态钙原子的价层电子排布式为____________。基态磷原子的未成对电子数为______________。
(2)碱式磷酸钙中含氧酸根离子的中心原子杂化类型是______________________,含氧酸根离子的空间构型为______________;
(3)氢氟酸溶液中存在:2HF![]() H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
(4)O、F、P的电负性由小到大的顺序为______________。
(5)NH3和PH3的构型相似,NH3的键角略大于PH3,从原子结构角度解释其原因:________________。
(6)CaF2晶胞如图所示。位于体内的粒子的配位数为______________。

已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。
氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
B. 110 g Na2S2中含有的离子数为3NA
C. 0.1 mol·L-1 Na2CO3溶液1 L所含碳酸根数目为0.1NA
D. 1 mol Cl2与足量的水反应时断裂的Cl-Cl键为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
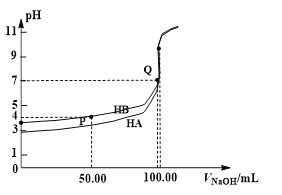
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对熟石灰的悬浊液加热,悬浊液中固体质量增加
B. 实验室中常用排饱和食盐水的方式收集氯气
C. 打开汽水瓶,有气泡从溶液中冒出
D. 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com