
| A、烧杯中固体有铜无铁 |
| B、烧杯中溶液有Fe3+、Fe2+,无Cu2+ |
| C、烧杯中固体铁、铜都有,溶液中只有Fe2+ |
| D、烧杯中铁、铜都无,溶液有Fe2+、Cu2+ |


科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
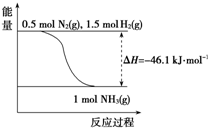
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Cl>Mg>Na |
| B、酸性:H2SiO3>H2CO3>HNO3 |
| C、稳定性:HF<NH3<CH4 |
| D、碱性:LiOH<NaOH<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 溶液中阳离子 | Cu2+、Fe3+、Zn2+ | Cu2+、Fe2+ | Cu2+、Fe2+、Zn2+ | Cu2+、Fe2+ |
| 底部 金属 | Cu | Fe、Zn | Cu | Cu、Fe |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、980 ml,114.7g |
| B、500ml,58.5g |
| C、1000 ml,117 g |
| D、1000ml,117.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制取干燥的氨气 |
B、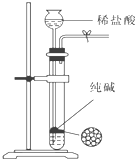 可用于制取少量纯净的CO2气体 |
C、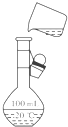 将溶液定容到100mL |
D、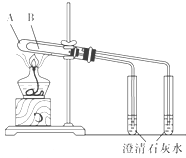 可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取所需的盐酸时俯视刻度线 |
| B、定容时,仰视刻度线 |
| C、用量筒量取所需浓盐酸注入盛有适量蒸馏水的烧杯后,再分别用少量蒸馏水洗涤玻璃棒、量筒2-3次,洗涤液注入25 0 mL容量瓶中 |
| D、定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| C、实验桌上的酒精灯倾倒了燃烧起来,马上用湿抹布扑灭 |
| D、实验时,将水倒入浓硫酸中配制稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com