
【题目】下列各项叙述中,正确的是( )
A. 2p和3p轨道形状均为哑铃形,能量也相等
B. 氮原子的价电子排布图:![]()
C. 利用手性催化剂合成可得到一种或主要得到一种手性分子,手性异构体性质相同
D. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
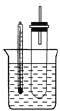
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)A的结构式为 ________________;C的结构简式为_________________;
(2)写出反应①的化学方程式_________________;
(3)反应③的反应类型为__________________;
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)______________;_______________。
(5)反应 ________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化反应之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
A. 及时除去二氧化碳,正反应速率加快
B. 混合气体的密度不变是该平衡状态的标志之一
C. 降低温度,反应物的转化率和平衡常数均增大
D. 其它条件不变,加入催化剂可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是( )
A.向0.1mol·L-1 CH3COONa溶液中加入少量水,溶液中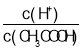 减小
减小
B.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分不同
C.向盐酸中加入氨水至中性,溶液中![]() =1
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除CO。已知:
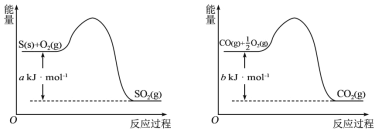
则用SO2除去CO的热化学方程式为___。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:
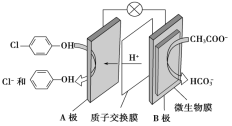
①B是电池的___极(填“正”或“负”);
②A极的电极反应式为____。
(3)利用双模三室电解法不仅可处理含NiCl2的废水,还可回收金属镍,其装置如图所示。
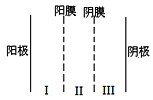
①两端电解质溶液分别为含NiCl2的废水和NaOH溶液,其中含NiCl2的废水应进___(填“Ⅰ”“Ⅱ”“Ⅲ”,下同)室。
②阳极的电极反应式为___。
(4)某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol·L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。
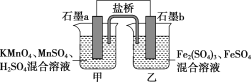
回答下列问题:
①此原电池的正极是石墨___(填“a”或“b”),发生___反应。
②电池工作时,盐桥中的SO42-移向____(填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(结构如图)可用于漂白羊毛、草等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
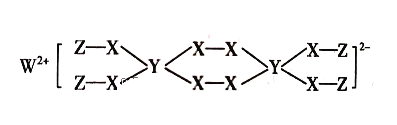
A.元素电负性顺序为:X>W>Y
B.Y的最高价氧化物对应水化物为强酸
C.工业上通过电解熔融的WX来制得W
D.该漂白剂中X、Y均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
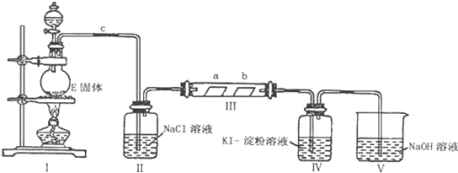
(1)实验室以二氧化锰和浓盐酸制备氯气的离子方程式是___。
(2)装置Ⅱ的作用是___。
(3)实验过程中,装置IV中的实验现象为___;发生反应的化学方程式为___。
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的___装置(填序号),该装置的作用是___。
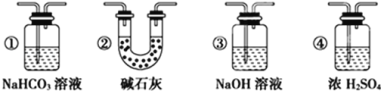
(5)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com