
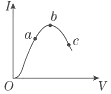
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
分析 (1)导电能力越强,离子浓度越大,氢离子浓度越大;
(2)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;
(3)电离平衡常数越大酸性越强,电离平衡常数越小酸性越弱;
(4)①硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-;②氨水是弱电解质部分电离,电离方程式为:NH3•H2O?NH4++OH-;
解答 解:(1)由于导电能力越强,溶液中离子浓度越大,氢离子浓度越大,故答案为:c<a<b;
(2)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度的是c,故答案为:c;
(3)电离平衡常数越大酸性越强,电离平衡常数越小酸性越弱,由表可知:醋酸的电离平衡常数最大,所以酸性最强的是CH3COOH,电离平衡常数最小的是次氯酸,所以酸性最弱的是次氯酸,故答案为:CH3COOH;HClO;
(4)①硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-,故答案为:H2SO4═2H++SO42-;
②氨水是弱电解质部分电离,电离方程式为:NH3•H2O?NH4++OH-,故答案为:NH3•H2O?NH4++OH-.
点评 本题考查电解质的电离,题目难度中等,加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比各组分金属的低 | B. | 合金中可能含有非金属元素 | ||
| C. | 合金中肯定含有金属元素 | D. | 合金的熔点一般比各组分金属的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
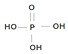 (为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为
(为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为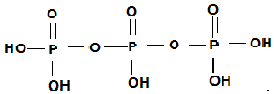 ;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由W 与X 组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | Y的气态简单氢化物的稳定性比Z的强 | |
| D. | W、Y、Z三种元素可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 4:1 | D. | l:l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com