
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+2H2(g)═CH3OH(g) | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | C(s)+O2(g)═CO2(g) | D. | 2Hg(l)+O2(g)═2HgO(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g N2所含原子数为NA | B. | 0.5mol H2O所含原子数为1.5NA | ||
| C. | 1mol H2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者相等 | B. | 前者大 | C. | 后者大 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
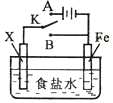
| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | |
| B. | 若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| C. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 | |
| D. | 若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:6 | B. | 2:1:6 | C. | 8:8:117 | D. | 117:4:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-=Cu(OH) 2↓+SO42- | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ②或④ | C. | ①或③ | D. | ③或④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com