
在一定条件下,发生反应:2X(g)+Y(g)  2Z(g) ΔH=-197kJ·mol-1,若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
2Z(g) ΔH=-197kJ·mol-1,若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
A.10min内,反应放出的热量为197kJ热量
B.10min内,X的平均反应速率为0.06mol·L-1·min-1
C.第10min时,Y的反应速率小于0.015mol·L-1·min-1(假如体系温度不变)
D.第10min时,Z浓度为0.6mol·L-1
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:实验题
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)
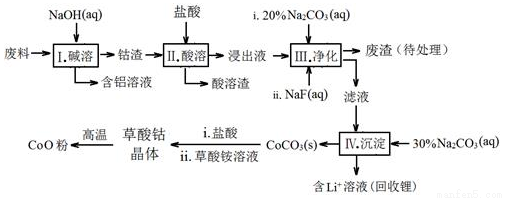
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 .
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 .
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是 .温度高于890℃时,固体产物发生分解反应,固体产物为 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知:(1)H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
(2)1/2N2 (g) + O2(g)=NO2(g) △H=+33.9 kJ/mol
(3)1/2N2 (g) +3/2 H2(g)=NH3(g) △H=-46 .0 kJ/mol
.0 kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热
A.28 2.8 kJ/mol B.-282.8 kJ/mol C.848.4kJ/mol D.-848.4 kJ/mol
2.8 kJ/mol B.-282.8 kJ/mol C.848.4kJ/mol D.-848.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线


若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g)  2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g)  2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g)  SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)  SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
将乙醇滴入热的浓硫酸中,发生反应:C2H5OH +6H2SO4 = 6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )
A.氧化性 B.脱水性 C.酸性 D.吸水性
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.二氧化锰和浓盐酸反应:MnO2+4HCl(浓) Mn2++2Cl2↑+ 2H2O
Mn2++2Cl2↑+ 2H2O
B.稀盐酸和硅酸钠溶液反应:SiO32-+2H+=H2SiO3↓
C.碳酸钙和稀盐酸反应:CO32-+2H+=CO2↑+H2O
D.铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.氯气可用于自来水的消毒 B.二氧化硅是半导体材料
C.氢氧化铁胶体能用于净水 D.二氧化硫可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:填空题
一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数 ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g)  2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。

①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列反应不能用离子方程式“H++OH-=H2O”表示的是
A.H2SO4溶液与NaOH溶液混合 B.HCl气体通人Ca(OH)2溶液中
C.HNO3溶液与KOH溶液混合 D.NH4HSO4溶液与NaOH溶液混合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com