
下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
(3)H2(g)+ O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH为( )
| A.488.3 kJ/mol | B.-488.3 kJ/mol | C.-244.15 kJ/mol | D.244.15 kJ/mol |
科目:高中化学 来源: 题型:
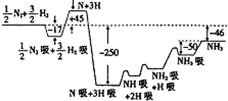 (1)合成氨反应的机理为
(1)合成氨反应的机理为 H2吸
H2吸 2H
2H 2H吸
2H吸 H2吸
H2吸 2H
2H 2H吸
2H吸 2N
2N 2N吸
2N吸 NH吸
NH吸 NH吸
NH吸 NH2吸;
NH2吸; NH3吸
NH3吸 NH3.
NH3. 2NH3(g);H=-92kJ?mol-1
2NH3(g);H=-92kJ?mol-1 2NH3(g);H=-92kJ?mol-1
2NH3(g);H=-92kJ?mol-1 NH4++NH2-(某温度下其离子积常数为10-30).液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
NH4++NH2-(某温度下其离子积常数为10-30).液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4= [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
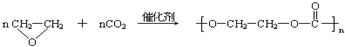
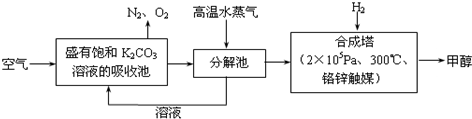
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
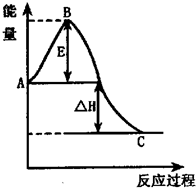 (2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)
(2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)| 催化剂 | 高温、高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com