

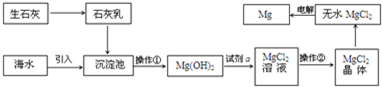
分析 (1)海水中溴元素以离子形式存在;
(2)浓缩海水,通过蒸发浓缩;
(3)二氧化硫水溶液吸收溴单质生成硫酸和溴化氢,纯碱溶液吸收法,溴单质发生歧化反应生成物是NaBrO3,NaBr,据此书写化学方程式;
(4)①采用方法I吸收是利用二氧化硫的还原性和溴单质反应生成两种强酸,取少量X,依次加入稀硫酸和四氯化碳,溴化钠和溴酸钠在酸性溶液中生成单质溴,溴单质在四氯化碳中溶解性大于水,发生萃取现象,下层呈橙红色;
②可以设计实验检验生成的硫酸溶液中硫酸根离子的存在.
解答 解:(1)海水中溴元素主要以形式Br-存在,故选A,
故答案为:A;
(2)浓缩海水,通过蒸发浓缩,用到的仪器有玻璃棒、三脚架、酒精灯、蒸发皿等,冷凝管是蒸馏中冷凝馏分的仪器,坩埚用于加热固体,
故答案为:AE;
(3)方法I、二氧化硫水溶液吸收水是二氧化硫水溶液吸收溴单质生成硫酸和溴化氢,二氧化硫为反应中的还原剂,方法II、纯碱溶液吸收法,溴单质发生歧化反应生成物是NaBrO3,NaBr,反应的化学方程式为:3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑,
故答案为:还原剂; 3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑;
(4)①采用方法I吸收是利用二氧化硫的还原性和溴单质反应生成两种强酸,用玻璃棒蘸取少量X点在pH试纸上,试纸呈红色,证明X是采用方法I吸收的;
取少量X,依次加入稀硫酸和四氯化碳,溴化钠和溴酸钠在酸性溶液中生成单质溴,溴单质在四氯化碳中溶解性大于水,发生萃取现象,下层呈橙红色,有关反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,证明X是采用方法II吸收的,
故答案为:红;下; 5Br-+BrO3-+6H+=3Br2+3H2O;
②实验验证X是采用方法I吸收溴所得的溶液,可以设计实验检验生成的硫酸溶液中硫酸根离子的存在,具体步骤为取少量X,加入几滴BaCl2溶液,若有白色沉淀生成,则X是用方法I吸收的,
故答案为:取少量X,加入几滴BaCl2溶液,若有白色沉淀生成,则X是用方法I吸收的.
点评 本题考查了海水资源的综合应用,主要是溴的制备、富集、生成等过程分析,注意离子检验方法、离子反应等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4.4 g二氧化碳含有的分子数为0.1NA | |
| B. | 锌从盐酸中置换出1 mol H2,电子转移数为NA | |
| C. | 常温常压下,11.2 L氧气含有的原子数为NA | |
| D. | 1 mol•L-1CaCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.
可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下X的单质能置换Z的单质 | |
| B. | X、Z、R所形成的离子半径:R>Z>X | |
| C. | Y的单质在R的单质中燃烧可形成白色烟雾 | |
| D. | X和Z的气态氢化物的稳定性:X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:
乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 78.2 | 100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com