
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
分析 A.磁性氧化铁为四氧化三铁,属于难溶物质;
B.向Na2SiO3溶液中通入过量SO2生成NaHSO3;
C.NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时,生成产物为BaSO4、NaOH和水;
D.Na2S2O3溶液中加入稀硫酸生成二氧化硫、S、硫酸钠和水.
解答 解:A.磁性氧化铁为四氧化三铁,属于难溶物质,四氧化三铁与稀硝酸反应生成NO、硝酸铁和水,则离子方程式为:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故A错误;
B.向Na2SiO3溶液中通入过量SO2生成NaHSO3,则向Na2SiO3溶液中通入过量SO2,离子方程式为:SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故B错误;
C.NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时,生成产物为BaSO4、NaOH和水,其反应的离子方程式为:H++SO42-+OH-+Ba2+═BaSO4↓+H2O,故C正确;
D.Na2S2O3溶液中加入稀硫酸生成二氧化硫、S、硫酸钠和水,反应的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,故D错误.
故选C.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.1molKClO2 | D. | 0.2molKClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应是可逆反应 | |
| B. | 放电时,镉为正极 | |
| C. | 充电时电池上标有“+”号的电极连接电源正极 | |
| D. | 以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L电池中转移了2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$ | B. | 14 | C. | $\frac{1}{49}$ | D. | 49 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
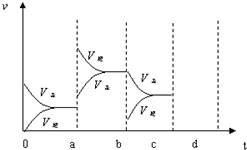 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com