
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
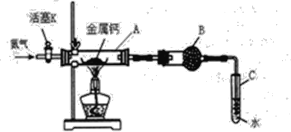
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
【答案】BC 2.8 Ca3N2+6H2O=3Ca(OH)2+2NH3 32 2Fe3++2I-=2Fe2++I2 11.2g
【解析】
(一)(1)反应产生的尾气氮气不与水反应也不溶于水,把导管插入水中可以防止空气从导管进入装置而造成氧气与钙发生反应;
(2)由实验数据表中数据,计算参加反应钙的质量及生成氮化钙的质量,根据反应的化学方程式,由两物质的质量计算氮化钙化学式中x值;
(3)Ca3N2与水反应生成氢氧化钙与氨气。
(二)(1)根据电子得失,得出SO2与电子数的关系;
(2)氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质;(3)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量。
(1)末端导管必须插入试管C的水中,可起到观察气体流速以及防止氧气进入反应装置,起到隔绝氧气的作用,防止钙与氧气反应而变质,故答案为:BC。
(2)参加反应钙的质量=15.08g14.80g=0.28g,参加反应的氮元素的质量为: 15.15g15.08g=0.07g,
xCa+N2═CaxN2
40x 28
0.28g 0.07g
![]() =
=![]() ,解得 x=2.8。
,解得 x=2.8。
故答案为:2.8。
(3)Ca3N2能与水反应生成氨气和氢氧化钙,反应方程式为:Ca3N2+6H2O=3Ca(OH)2+2NH3,故答案为:Ca3N2+6H2O=3Ca(OH)2+2NH3。
(二)(1)3FeS2+8O2![]() 6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,故答案为:32mol。
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,故答案为:32mol。
(2)氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2。
(3)依次发生反应为Fe2O3+6HCl=2FeCl3+3H2O;Fe+ 2FeCl3=3FeCl2;Fe+2HCl=FeCl2+H2↑;n(H2)=![]() =0.1mol,过量的铁粉与盐酸反应的物质的量为:
=0.1mol,过量的铁粉与盐酸反应的物质的量为:
Fe~~~~2HCl~~~~H2
0.1mol 0.2mol 0.1mol
根据氯原子守恒,FeCl3的物质的量为×[n(HCl)-2n(H2)]=0.16L×5mol/L-0.2mol)=0.2mol
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,故答案为:11.2g。


科目:高中化学 来源: 题型:
【题目】(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式: ![]() ____、____、____、____、____、___、
____、____、____、____、____、___、
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:![]()
①该反应的氧化剂是____________氧化产物与还原产物的物质的量比是 __________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,28.80g金属单质A与1.20molCl2完成反应,生成1.20molAClx,则x=__________,若A原子核内质子数等于中子数,则A原子核内中子数为__________ ,氯原子结构示意图为____________。
(2)现有氨气3.4g,在标准状况下其体积为____________,含有氮原子的数目为_____ ;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2下列说法正确的是( )
A. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达不正确的是 ( )
A. 向FeCl3溶液滴加HI溶液:2Fe3++2I-== 2Fe2++I2
B. CuSO4溶液吸收H2S 气体:Cu2++H2S == CuS↓+2H+
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH- == NO![]() +NO
+NO![]() +H2O
+H2O
D. 向NH4Al(SO4)2溶液中滴加少量Ba(OH)2溶液:2NH4++Ba2++SO42-+2OH—= BaSO4↓+2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地区的雾霾中可能含有下列可溶性离子:Na+、Ba2+、Mg2+、Fe3+、SO42-、Cl-、CO32-。某学习小组收集了该地区的雾霾,经必要的预处理后配成试样溶液,并完成了如下实验:①取试样溶液100mL,加入足量BaCl2溶液,得到白色沉淀2.33g。②另取试样溶液100mL,加入足量NaOH溶液,得到白色沉淀1.16g。根据实验结果下列说法正确的是
A.该雾霾肯定不含Ba2+、Fe3+,可能含有CO32-
B.该雾霾肯定含有Mg2+、SO42-、Cl-,可能含有Na+
C.试样溶液中SO42-的物质的量浓度为0.01 mol/L
D.向实验①和②所得白色沉淀中加入盐酸,沉淀均可溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH![]() 、Al3+、SO
、Al3+、SO![]() 、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
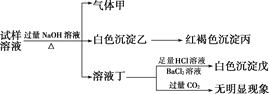
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样溶液中肯定有NH![]() 、SO
、SO![]() 和Fe2+
和Fe2+
B. 试样溶液中一定没有Al3+
C. 若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断试样溶液中还有Cl-
D. 该盐在工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu+H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
O2(g)=Cu2O(s);△H=﹣169kJmol﹣1
②C(s)+![]() O2(g)=CO(g);△H=﹣110.5kJmol﹣1
O2(g)=CO(g);△H=﹣110.5kJmol﹣1
③Cu(s)+![]() O2(g)=CuO(s);△H=﹣157kJmol﹣1
O2(g)=CuO(s);△H=﹣157kJmol﹣1
则方法a发生的热化学方程式是:_____。
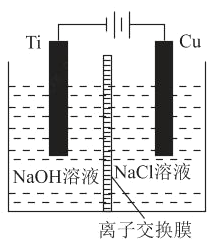
(2)方法c采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为_____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值_____(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为_____。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
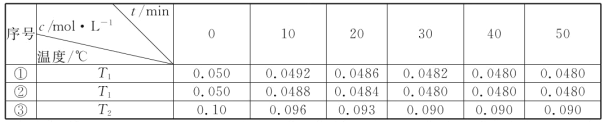
①对比实验的温度:T2_____T1(填“>”“<”或“=”),能否通过对比实验①③到达平衡所需时间长短判断:_____(填“能”或“否”)。
②实验①前20min的平均反应速率 v(O2)=_____
③催化剂的催化效率:实验①_____实验②(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述正确的是
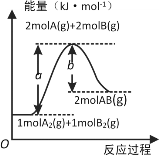
A. 形成2molA-B键,吸收b kJ能量
B. 每生成2分子AB吸收bkJ热量
C. 反应物的总能量低于生成物的总能量
D. 该反应热ΔH=(b-a)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com