
【题目】在50 m L 0.1mol/L Na2S 溶液中逐滴加入50 mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
【答案】C
【解析】A、两者恰好完全反应,反应后溶液中溶质为:Na2SO4、KHS,HS-水解:HS-+H2O ![]() H2S+OH-,溶液显碱性,故错误;B、根据选项A的分析,溶质为Na2SO4、KHS,Na+、K+不发生水解,根据投入量,c(Na+)>c(K+),HS-水解:HS-+H2O
H2S+OH-,溶液显碱性,故错误;B、根据选项A的分析,溶质为Na2SO4、KHS,Na+、K+不发生水解,根据投入量,c(Na+)>c(K+),HS-水解:HS-+H2O ![]() H2S+OH-,溶液显碱性,c(OH-)>c(H+)>c(S2-),因此离子浓度大小顺序是:c(Na+)>c(K+)> c(OH-)>c(H+)>c(S2-),故错误;C、根据物料守恒,c(Na+)=0.1mol·L-1,c(S2-)+c(HS-)+c(H2S)=0.05mol·L-1,c(SO42-)=0.05mol·L-1,因此有c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-),故正确;D、根据电荷守恒,应有c(K+)+ c(Na+)+ c(H+)= 2c(SO42-)+ 2c(S2-)+ c(HS-)+ c(OH-),故错误。
H2S+OH-,溶液显碱性,c(OH-)>c(H+)>c(S2-),因此离子浓度大小顺序是:c(Na+)>c(K+)> c(OH-)>c(H+)>c(S2-),故错误;C、根据物料守恒,c(Na+)=0.1mol·L-1,c(S2-)+c(HS-)+c(H2S)=0.05mol·L-1,c(SO42-)=0.05mol·L-1,因此有c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-),故正确;D、根据电荷守恒,应有c(K+)+ c(Na+)+ c(H+)= 2c(SO42-)+ 2c(S2-)+ c(HS-)+ c(OH-),故错误。


科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
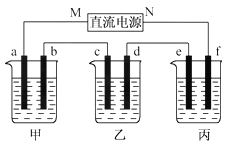
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为____________极;
②电极b上发生的电极反应为____________________;
③列式计算电极b上生成的气体在标准状况下的体积:________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液__________________;乙溶液___________________;丙溶液______________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,是一种常用的食品添加剂.该化合物具有如下性质:①在25℃时,A的电离平衡常数K1=3.9×10-4,K2=5.5×10-6②A+RCOOH(或ROH)![]() 有香味的产物③1molA
有香味的产物③1molA![]() 慢慢产生1.5mol气体④核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,与A相关的反应框图如下:
慢慢产生1.5mol气体④核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,与A相关的反应框图如下:
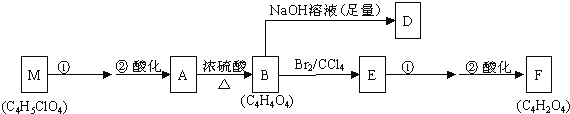
(1)根据化合物A的性质,对A的结构可作出的判断是______.
(a)肯定有碳碳双键(b)有两个羧基(c)肯定有羟基(d)有-COOR官能团
(2)写出A、D、F、M的结构简式:A:____________;D:______;F:______;M:______.
(3)写出A→B、B→E的反应类型:A→B____________;B→E_________________.
(4)写出M→A的第①步反应的反应条件:________________;写出E→F的第①步反应的反应方程式:______________________.
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.写出该反应的化学方程式:____________________.
(6)写出一种与A具有相同官能团的A的同分异构体的结构简式______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A.1 mol O的质量为16 g B.1 mol氮的质量为 28 g/mol
C.1 mol C的质量为12 g/mol D.1 mol 氢的质量为1 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物沸点比较错误的是:( )
A. 丙烷>乙烷>甲烷 B. 正戊烷>异戊烷>新戊烷
C. 邻二甲苯>间二甲苯>对二甲苯 D. 对二甲苯>邻二甲苯>间二甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定:室内甲醛含量不得超过0.08mgm﹣3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务(部分装置如图),其反应原理及步骤如下:
4MnO4﹣+5HCHO+H+═Mn2++5CO2↑+11H2O
2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
步骤:①量取5.00mL 1.00×10﹣3molL﹣1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10﹣3molL﹣1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气,再将注射器气体推入洗气瓶中充分反应,再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL),3次实验消耗草酸溶液的体积平均值为12.38mL。
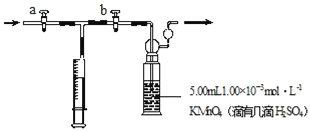
回答下列问题
(1)5.00mL高锰酸钾用_____量取。
(2)此实验用指示剂_____(填字母)。
a甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(3)计算该居室内空气中甲醛的浓度_____mgm﹣3。
(4)下列操作能引起室内甲醛浓度偏高的是_____。
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(5)草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,如果向10 mL 0.01molL﹣1H2C2O4溶液中滴加0.01 molL﹣1NaOH溶液
①当加入的NaOH溶液体积为10mL,请你写出溶液中质子守恒关系式_____。
②当加入的NaOH溶液体积为20mL,请你写出溶液中离子的浓度大小关系_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是
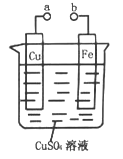
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是( )
A.焰火的五彩缤纷是某些金属元素的性质的展现
B.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会对人体健康造成较大危害的是( )
A.自来水中通入少量Cl2进行消毒杀菌
B.为漂白银耳大量使用SO2
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打发酵面团制作馒头
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com