
【题目】化学与生活、生产密切相关,下列有关说法正确的是
A.硅晶体具有半导体性能,可用于制取光导纤维
B.二氧化硫不仅可以漂白纸浆还可用于杀菌消毒
C.硅酸可以用于刻蚀玻璃
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】在探索原子结构的过程中做出主要贡献的科学家及其成就错误的是
A.波尔提出了原子结构的轨道模型
B.道尔顿提出近代原子论
C.拉瓦锡基于电子的发现提出葡萄干面包模型
D.卢瑟福通过α粒子散射实验提出了行星模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在无色溶液中大量共存的是
A. H+、 K+、 CO32-、 SO42- B. Fe3+、Na+、NO3-、SO42-
C. Mg2+、Ba2+、OH-、NO3- D. K+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比P电子数多3个,Y、Z均位于第二周期且两元素原子的最外层电子数之和为11,Z、R同主族,M核外电子有26种运动状态,请回答下列问题:
(1)元素M的基态原子的核外电子排布式为_________________。
(2)第一电离能:Y_____(填“ > ”或“<”)Z。
(3)化合物XCl3中心原子的杂化轨道类型为________;RC12的立体构型为_______。
(4)H2Z、H2R的沸点分別为100℃、-60.4℃,试解释其原因:_____________________________。
(5)R、M形成的一种化合物晶胞如图所示。
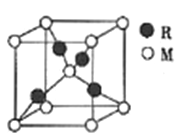
①该化合物的化学式为_____________。
②若晶胞参数为a pm。列式计算该晶胞的密度ρ=______g·㎝-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的转换在生产、生活中具有重要的应用。
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”。
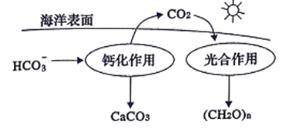
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为_________、___________________。
②在海洋碳循环中,可通过上图所示的途径固碳。写出钙化作用的离子方程式:____________。
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5molCO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据_______(填字母)。
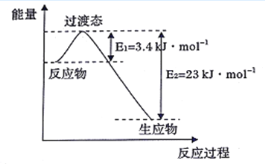
a.容器中压强不变 b.H2的体积分数不变
c.c(H2 =3c(CH3OH) d.容器中密度不变
e.2个C = O断裂的同时有6个H - H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g) +H2(g),得到如下三组数据:
CO2(g) +H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=____________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值_________(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正____v(逆)(填“ <”、“ >”或“=")。
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
③H2O(g)=H2O(I) △H=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. Na2S的水解:S2ˉ+ 2H2O![]() H2S +2OHˉ
H2S +2OHˉ
B. 将铁粉加入稀硫酸中: ![]()
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ +2H2O
D. 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
A. 向水中加入少量的CH3COONa
B. 向水中加入少量的NaHSO4
C. 加热水至100℃,pH=6
D. 向水中加少量的KAl(SO4)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015mol时发生的反应是:
0.015mol时发生的反应是:
2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪组糖类物质能与①~③中的叙述依次对应( )
①存在于RNA中而不存在于DNA中的糖类
②存在于植物细胞中而不存在于动物细胞中的二糖
③存在于动物细胞中而不存在于植物细胞中的多糖
A. 核糖、麦芽糖、乳糖 B. 脱氧核糖、乳糖、乳糖
C. 核糖、蔗糖、糖原 D. 脱氧核糖、麦芽糖、糖原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com