
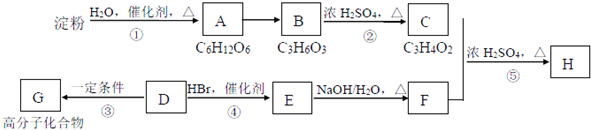
 ;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.
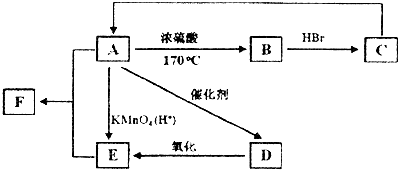
;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.分析 烃D的相对分子质量为42,则其含C原子个数为$\frac{42}{12}$=3---6,说明其分子式为C3H6,D是石油裂解气的主要成分,应为丙烯CH3CH=CH2,丙烯与HBr发生加成反应生成的E分子中只有两种类型的氢,则E为CH3CHBrCH3,E在NaOH的水溶液中水解生成醇F为CH3CHOHCH3,D在一定条件下生成高分子化合物G是丙烯的加聚反应,反应方程式为 ,淀粉水解生成的A为葡萄糖,葡萄糖水解生成乳酸
,淀粉水解生成的A为葡萄糖,葡萄糖水解生成乳酸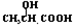 ,C 能使溴的四氯化碳溶液褪色,说明乳酸发生消去反应生成的C为CH2=CHCOOH,其与CH3CHOHCH3通过酯化反应生成H,据此分析.
,C 能使溴的四氯化碳溶液褪色,说明乳酸发生消去反应生成的C为CH2=CHCOOH,其与CH3CHOHCH3通过酯化反应生成H,据此分析.
解答 解:烃D的相对分子质量为42,则其含C原子个数为$\frac{42}{12}$=3---6,说明其分子式为C3H6,D是石油裂解气的主要成分,应为丙烯CH3CH=CH2,丙烯与HBr发生加成反应生成的E分子中只有两种类型的氢,则E为CH3CHBrCH3,E在NaOH的水溶液中水解生成醇F为CH3CHOHCH3,D在一定条件下生成高分子化合物G是丙烯的加聚反应,反应方程式为 ,淀粉水解生成的A为葡萄糖,葡萄糖水解生成乳酸
,淀粉水解生成的A为葡萄糖,葡萄糖水解生成乳酸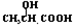 ,C 能使溴的四氯化碳溶液褪色,说明乳酸发生消去反应生成的C为CH2=CHCOOH,其与CH3CHOHCH3通过酯化反应生成H,
,C 能使溴的四氯化碳溶液褪色,说明乳酸发生消去反应生成的C为CH2=CHCOOH,其与CH3CHOHCH3通过酯化反应生成H,
(1)淀粉是多糖,淀粉水解生成的A为葡萄糖,葡萄糖是多羟基醛,结构简式为CH2OH(CHOH)4CHO,故答案为:多;CH2OH(CHOH)4CHO;
(2)C 能使溴的四氯化碳溶液褪色,说明乳酸发生消去反应生成的C为CH2=CHCOOH,其含有碳碳双键和羧基;CH2=CHCOOH与CH3CHOHCH3通过酯化反应生成H,H的结构简式为CH2=CHCOOCH(CH3)2,故答案为:碳碳双键和羧基;CH2=CHCOOCH(CH3)2;
(3)淀粉水解生成葡萄糖的化学方程式为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6,D在一定条件下生成高分子化合物G是丙烯的加聚反应,反应方程式为 ,丙烯与HBr发生加成反应生成的E分子中只有两种类型的氢,则E为CH3CHBrCH3,化学方程式为CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3,
,丙烯与HBr发生加成反应生成的E分子中只有两种类型的氢,则E为CH3CHBrCH3,化学方程式为CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3,
故答案为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6; ;加聚反应;CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;加成反应;
;加聚反应;CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;加成反应;
(4)B为乳酸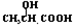 ,其可能的同分异构体有CH2OHCH2COOH,CH2OHCHOHCHO,故答案为:CH2OHCH2COOH;CH2OHCHOHCHO.
,其可能的同分异构体有CH2OHCH2COOH,CH2OHCHOHCHO,故答案为:CH2OHCH2COOH;CH2OHCHOHCHO.
点评 本题考查有机物推断、烯与氯代烃、醇之间的转化关系以及酯化反应等,难度不大,注意基础知识的理解掌握.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
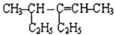 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯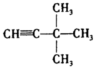 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学平衡:
化学平衡:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,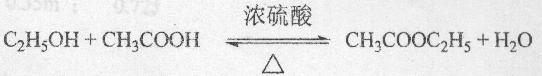 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O(注明反应条件).
+NaCl+H2O(注明反应条件).

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. .
. +Br2→
+Br2→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 任何条件下,等物质的量的CO和NO所含的分子数一定相等 | |
| C. | 1L CO气体一定比1L O2的质量小 | |
| D. | 相同条件下的CO和N2,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com