
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
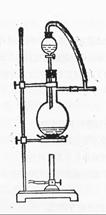
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?可以用图二代替吗?。
图一 图二
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源:江西省上高二中2011届高三第二次月考化学试题 题型:实验题
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐, 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
| A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高 | |
| B.防止生成的盐分解 | C.催化剂在冷水中活性最强 |
| D.该反应是放热反应,为防止温度过高,采用降温 |
 可以用图二代替吗?。
可以用图二代替吗?。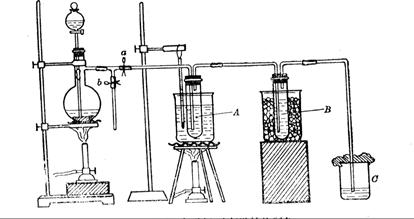
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
|
化学方程式 |
K (T1 ) |
K (T2) |
|
F2+H2 |
1.8 ×1036 |
1.9 ×1032 |
|
Cl2+H2 |
9.7 ×1012 |
4.2 ×1011 |
|
Br2+H2 |
5.6 ×107 |
9.3 ×106 |
|
I2+H2 |
43 |
34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a.在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐减弱
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。

①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
查看答案和解析>>
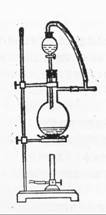
科目:高中化学 来源:江西省2010-2011学年高三第二次月考化学试题 题型:实验题
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?可以用图二代替吗?。

图一 图二
查看答案和解析>>
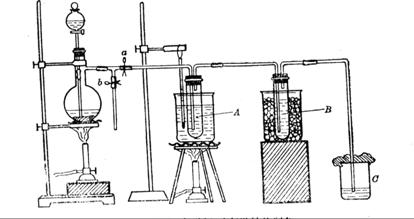
科目:高中化学 来源: 题型:
为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?![]()
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,![]() 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?![]() 可以用图二代替吗?。
可以用图二代替吗?。
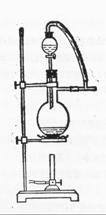
图一 图二
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com