

| 112 |
| 160 |
| 152 |
| 56 |
| 1.7024g |
| 0.3g×10 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省焦作市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:

(1)药片上的糖衣可以起__________的作用,鉴定时溶解加盐酸的目的是____________。
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
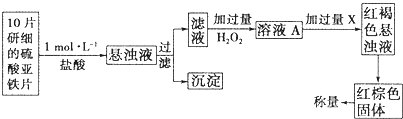
(3)另一研究小组乙设计了如下测量方案:
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤????? B.洗涤????? C.萃取???? D.分液???? E.冷却???? F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为_________(小数点后面保留一位有效数字)。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
硫酸亚铁片
硫酸亚铁片
本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0%。
【性状】 本品为糖衣片,除去糖衣后显淡蓝绿色。
【鉴别】 取本品,除去糖衣,研细,称取适量(约相当于硫酸亚铁0.2 g),加稀盐酸1滴与水20 mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应。
【规格】 0.3 g
【贮藏】 密封,在干燥处保存。
(1)药片上的糖衣可以起________的作用,鉴定时溶解加盐酸的目的是____________
____________________________________.
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平外,还需要的仪器有________、________、________、________、 ________。
②滴定时含硫酸亚铁的滤液放在________(填仪器)中,高锰酸钾溶液放在_____(填仪器)中,滴定终点时溶液的颜色为________色。
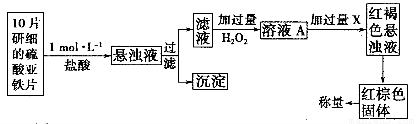
(3)另一研究小组乙设计了如下测量方案:

①过滤时用到的玻璃仪器有______________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com