
【题目】下列物质属于纯净物的是
A. 玻璃 B. 蒸馏水 C. 粗盐 D. 空气
科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
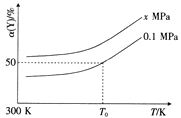
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g) ![]() 3C(g)+5D(g)的反应中,表示该反应速率最快的是
3C(g)+5D(g)的反应中,表示该反应速率最快的是
A. v (D)= 4.0 mol/(L·s)B. v (C)=3.2mol/(L·s)
C. v (A)= 2.0mol/(L·s)D. v (B)= 1.2mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示。则下列结论正确的是( )
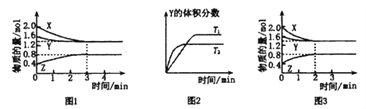
A. 容器中发生的反应可表示为:4X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
C. 升高温度,反应的化学平衡常数K增大
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如下:
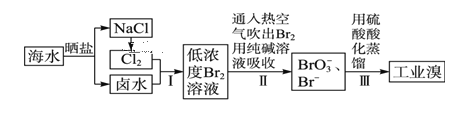
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_______。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的__________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面横线上填入适当的化学计量数:_____Br2+_____CO32-=_____ BrO3-+_____Br-+_____CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是__________。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。
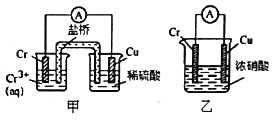
(1)在上图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论_______________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(VI)转化为Cr(III)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O72-的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaC1进行电解,使阳极生成的Fe2+和Cr2O72-发生反应,其离子方程式为___________。阴极上Cr2O72-、H+、Fe3+都可能放电。若Cr2O72-放电,则阴极的电极反应式为_________;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(VI)的废水中加入绿矾,在pH<4时发生反应使Cr(VI)转化为Cr(III),调节溶液pH为6~8,使溶液中的Fe(I)、Fe(Ⅱ)、Cr(III)析出组成相当于Fe(Ⅱ)[Fe(III)x·Cr (III)2-x]O4(铁氧磁体 的沉淀,则铁氧磁体中x=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com