
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C��s��+CO2��g��2CO��g����ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����֪�����ѹ��P����=������ѹ��P�������������������˵����ȷ���ǣ� �� 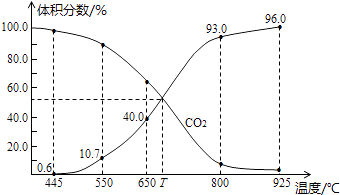
A.550��ʱ��������������壬v�� �� v������С��ƽ�ⲻ�ƶ�
B.650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C.T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=24.0P��
���𰸡�B
���������⣺A���ɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ������������壬�൱�ڼ�Сѹǿ����v�� �� v������С���ָ÷�Ӧ�������������ķ�Ӧ����ƽ�������ƶ�����A���� B����ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol��ת����xmol������
C��s��+ | CO2��g�� | 2CO��g�� | |
��ʼ | 1 | 0 | |
ƽ�� | X | 2x | |
ת�� | 1-x | 2x |
���� ![]() ��100%=40%�����x=0.25mol����CO2��ת����Ϊ
��100%=40%�����x=0.25mol����CO2��ת����Ϊ ![]() ��100%=25%����B��ȷ��
��100%=25%����B��ȷ��
C����ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬������ƽ�ⲻ�ƶ�����C����
D��925��ʱ��CO���������Ϊ96%����CO2�����������Ϊ4%��������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp= ![]() =
= ![]() =23.0P����D����
=23.0P����D����
��ѡ��B��
A���ɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ������������壬�൱�ڼ�Сѹǿ����v�� �� v������С���ָ÷�Ӧ�������������ķ�Ӧ����ƽ�������ƶ���
B����ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol����������ʽ���м��㣻
C����ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬��
D��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp= ![]() ���ݴ˼��㣻
���ݴ˼��㣻



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.�Ŵ����̽��������˵��ԭ��
B.����ɰ��HgS����֮��ˮ���������ֻ��ɵ�ɰ����Ϊ���淴Ӧ
C.�Ŵ����á��dz�ˮ��Ϊ��ˮ�����к���5����
D.�����ỵ֮�ƣ��Կ����ա����漰�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ���ǣ� ��
A. Mg��ϡ���ᷴӦB. ϡ�����NaOH��Һ��Ӧ
C. ����ʯ��ʯD. CH4ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����ȡ����Ӧ����
A. ����������ˮ�ⷴӦ
B. �����ڹ���������������������Ӧ
C. ����Ũ�����Ũ����Ļ��Һ����
D. ��ͭ�������������£��Ҵ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪij�о���ѧϰС��̽��������ʴ������ʵ��װ��ͼ���Է���ʵ�鲢�ش��������⣺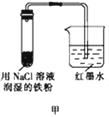
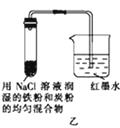

��1����ʼʱ���ס��ҡ�������װ�õĵ�����Һ��߶���ͬ�����һ��ʱ�����Һ����ߵ�������װ�ô��ţ���
��2��ͨ���ס���װ�õĶԱ�ʵ��˵����������̼�ĺ���Խ����ߡ��͡���Խ���ױ���ʴ��
��3����װ���з����绯ѧ��ʴʱ�����ĵ缫��ӦʽΪ ��
��4��Ϊ��ֹ������ʴ����ҵ���ձ���õķ�������д��һ�㼴�ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ���;��ȷ����
A.�����ж����������ںϳ�ҩ��
B.�����������ϸ�ijЩ�����ϣ������Ƴɷ�������
C.�����������Գ���ʢ�Ÿ�����
D.����þ�����������źŵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20�� ʱ��PbCl2��s���ڲ�ͬŨ�������е�����ܽ�������λ��gL��1����ͼ��ʾ������������ȷ���ǣ� �� 
A.����Ũ��Խ��Ksp��PbCl2��Խ��
B.PbCl2����һ��Ũ�ȵ����ᷴӦ
C.x��y�����Ӧ����Һ��c��Pb2+�����
D.����Pb2+����Һ�м������Ũ���ᣬ�ɽ�Pb2+��ȫת��ΪPbCl2��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����绷�����˽���ȫ���ֹʹ��������������ˮ����������������ø�Ч����ɫ���������������ȣ�����������һ�ּ��ױ�ը��ǿ���������壬������ˮ�����ȶ����ʻ���ɫ����������ʹ��ʱ���뾡����ϡ���������ϡ�ͣ�ͬʱ��Ҫ������ա�����ȣ�ʵ�����Ե�ⷨ�Ʊ�ClO2���������£� 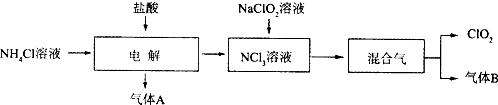
��֪����NCl3�ǻ�ɫ��״Һ���б���ξ��壬���ױ�ը�������������Ĵ̼�����ζ����ȼ��ը��Ϊ95�棬����ˮ���ֽ⣬�ڿ������ӷ������ȶ���������B��ʹʪ��ĺ�ɫʯ����ֽ������
�ش��������⣺
��1�����ʱ��������Ӧ�Ļ�ѧ����ʽΪ �� ʵ�����Ʊ�����B�Ļ�ѧ����ʽΪ �� Ϊ��֤ʵ��İ�ȫ���ڵ��ʱ��ע��������ǣ��ٿ��ƺ�����NCl3��Ũ�ȣ��� ��
��2��NCl3��NaClO2���������ƣ������ʵ���֮��Ϊ1��6��ϣ�����Һ��ǡ�÷�Ӧ����ClO2 �� �÷�Ӧ�����ӷ���ʽΪ ��
��3��ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ���������������ʵ�飺 ����1��ȷ��ȡClO2��Һ10mL��ϡ�ͳ�100mL������
����2����ȡV1 mL�������뵽��ƿ�У�����������pH��2.0������������KI���壬ҡ�ȣ��ڰ�������30min
����3���Ե�����Һ��ָʾ������c mol/L Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2 mL������֪I2+2S2O32��=2I��+S4O62����
����������3�еζ��յ����������
�ڸ�����������ɼ����ԭClO2��Һ��Ũ��Ϊg/L���ú���ĸ�Ĵ���ʽ��ʾ����
��4����һ���¶��£������ܽ������ֻ������ܵ��ܼ��е�Ũ��֮����һ������K����c��A����c��B����gL ![]() ���ֱ��ʾ������A��B�����ܼ��е�Ũ�ȣ�����
���ֱ��ʾ������A��B�����ܼ��е�Ũ�ȣ����� ![]() =K�����ڶ��ԣ�
=K�����ڶ��ԣ� ![]() =85������2.0L��ˮ�����к�I20.020g������CCl4��ȡ�������ַ�����ȡ����һ�ַ�����50mLCCl4��ȡһ�Σ��ڶ��ַ����Ƿ�������ȡ��ÿ����25mLCCl4 �� Ϊ�˱Ƚ����ַ���Ч���ã���������������µ�ˮ�в������������һ�ַ�����ˮ�в�������� �� �ڶ��ַ�����ˮ�в�������� ��
=85������2.0L��ˮ�����к�I20.020g������CCl4��ȡ�������ַ�����ȡ����һ�ַ�����50mLCCl4��ȡһ�Σ��ڶ��ַ����Ƿ�������ȡ��ÿ����25mLCCl4 �� Ϊ�˱Ƚ����ַ���Ч���ã���������������µ�ˮ�в������������һ�ַ�����ˮ�в�������� �� �ڶ��ַ�����ˮ�в�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ϡ���Ϣ����Դ��ϵ���С�����˵������ȷ����
A. ˮ�ࡢ�������մɶ��Ǵ�ͳ�Ĺ����ι�ҵ��Ʒ
B. ��ǰ̫���ܵ�ص���Ҫ�����Ƕ�������
C. ��ǰ�����ʹ�õĹ�оƬ��Ҫ�����ǹ�
D. �������ά����Ҫ�����Ƕ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com