
| A. | BaCl2有两性 | |
| B. | 两试管沉淀均是BaSO3 | |
| C. | SO2有还原性,酸性 | |
| D. | 升高PH,使SO2水溶液中SO32-浓度增大 |
分析 在BaCl2溶液中通入SO2气体不反应,将上述通入SO2气体的BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,加硝酸的试管中硝酸会氧化二氧化硫为硫酸,故能生成白色硫酸钡沉淀,加烧碱溶液,二氧化硫会与氢氧化钠反应生成亚硫酸盐,与氯化钡会生成亚硫酸钡白色沉淀,以此解答该题.
解答 解:A.氯化钡为强酸强碱盐,不具有两性,故A错误;
B.第一支试管里面生成沉淀为硫酸钡,第二支生成沉淀为亚硫酸钡,故B错误;
C.二氧化硫与氢氧化钠反应,为酸性氧化物,二氧化硫不具有酸性,与硝酸反应生成硫酸,表现为还原性,故C错误;
D.升高pH,碱性增强,与二氧化硫反应增大溶解度,则使SO2水溶液中SO32-浓度增大,故D正确;
故选D.
点评 本题考查了元素化合物知识,为高频考点,侧重于双基的考查,明确二氧化硫的还原性和酸性氧化物的性质是解题关键,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1 mol甲分子内含有10 mol共价键 | |
| B. |  由乙分子构成的物质不能发生氧化反应 | |
| C. |  丙分子的二氯取代产物只有三种 | |
| D. |  分子丁显然是不可能合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | 淀粉、纤维素、蛋白质、油脂是高分子化合物 | |
| D. | 煤的干馏、石油的分馏分别是化学变化、物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4mol/L,O2为0.2mol/L | B. | SO2为0.15mol/L | ||
| C. | SO2,SO3均为0.25mol/L | D. | SO3为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
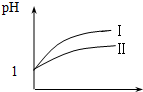 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com