
| A. | 原子半径的周期性变化 | B. | 电负性的周期性变化 | ||
| C. | 第一电离能的周期性变化 | D. | 原子核外电子排布的周期性变化 |
科目:高中化学 来源: 题型:选择题

| A. | 铜片上有气泡产生 | B. | 锌片逐渐溶解 | ||
| C. | 溶液逐渐变蓝 | D. | 电流计指针发生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 6.5 g | C. | 3 g | D. | 10 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径10-9m~10-7 m | |
| B. | 胶体在生物界普遍存在,应用也很广泛 | |
| C. | 用平行光照射氢氧化铁胶体产生一条光路,是由于光照使之发生分解生成氧化铁 | |
| D. | 氢氧化铁胶体净水是利用了胶体的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
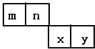 m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则: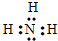 ,空间构型为三角锥形.
,空间构型为三角锥形.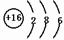 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
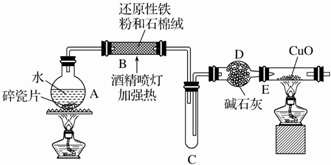
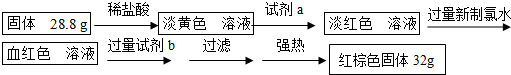
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com