
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、明矾溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:| 元素 | 元素相关信息 |
| a | 其单质的熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 |
| b | 原子核外有7种运动状态不同的电子 |
| c | 电负性最大 |
| d | 一种核素的质量数为35,中子数为18 |
| e | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作.
某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作. | 现象 | 结论 |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液不变色 | |
| ①中酸性KMnO4溶液不褪色 ②中KSCN溶液变红 | |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
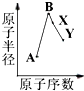 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
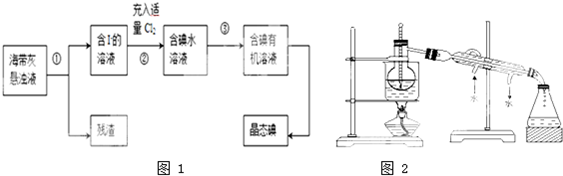
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸(CH2O2),俗称蚁酸,结构式为:
甲酸(CH2O2),俗称蚁酸,结构式为: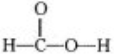 .某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com