
 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.分析 I.已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得:Ba(s)+S(s)+2O2(g)=BaSO4(s),反应热也进行相应的计算;
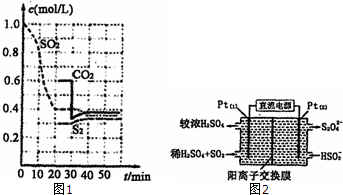
Ⅱ.(1)①根据v=$\frac{△c}{△t}$计算v(SO2);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.根据物料守恒判断;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒计算生成硫酸根、氢离子的物质的量,为保持溶液电中性,多余的氢离子通过阳离子交换膜移至右侧,左侧溶液中增加离子为生成硫酸电离的离子总量.
解答 解:I.已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,
根据盖斯定律:③×2-①-②得:Ba(s)+S(s)+2O2(g)=BaSO4(s),故△H=(-221 kJ?mol-1)×2-(+460 kJ?mol-1)-(+571.2 kJ?mol-1)=-1473.2KJ•mol-1,
故答案为:-1473.2KJ•mol-1;
Ⅱ.(1)①由图可知,0-20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.6mol/L}{20min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,故答案为:减少CO2的浓度;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误,
故答案为:abc;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,
故答案为:SO2-2e-+2H2O=SO42-+4 H+;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒,生成硫酸根物质的量$\frac{0.02mol}{2}$=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
故答案为:0.03.
点评 本题属于拼合型题目,涉及反应热计算、反应速率计算、化学平衡影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,(3)中左侧溶液中增加离子物质的量计算为易错点,学生容易根据电极反应式计算,忽略部分氢离子移至右侧.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
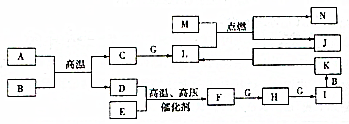 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
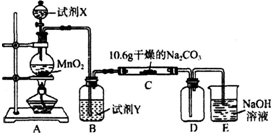
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
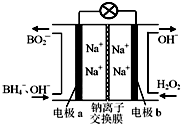 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 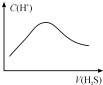 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12克金刚石中含有的C-C键数目为为4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4L乙烯与丙烯的混合物中含有的分子数目为NA | |
| D. | 常温常压下,Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com