
分析 (1)Cl2与NaOH反应生成NaCl,Cl的化合价降低1价,生成NaClO3,Cl的化合价升高5价,根据得失电子守恒和原子守恒配平方程式;
(2)硝酸根离子在酸性条件下具有强氧化性,能氧化亚铁离子;
(3)K37ClO3中Cl元素的化合价由+5价降低为+4价,H35Cl中Cl元素的化合价由-1价升高为0.
解答 解:(1)Cl2与NaOH反应生成NaCl,Cl的化合价降低1价,生成NaClO3,Cl的化合价升高5价,生成NaClO,Cl的化合价升高1价,则反应的离子方程式为:10Cl2+20OH-=16Cl-+3ClO3-+ClO-+10H2O;
故答案为:10Cl2+20OH-=16Cl-+3ClO3-+ClO-+10H2O;
(2)硝酸根离子在酸性条件下具有强氧化性,能氧化亚铁离子,发生的反应有:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)K37ClO3中Cl元素的化合价由+5价降低为+4价,H35Cl中Cl元素的化合价由-1价升高为0,所以生成的氯气中的Cl原子全部来源于H35Cl,则35Cl2的摩尔质量为70g/mol;
故答案为:70g/mol.
点评 本题考查氧化还原反应,把握元素的化合价变化及电子守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
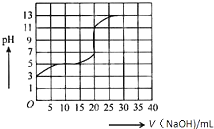 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
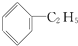 与
与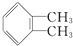
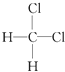 与
与
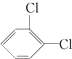 与
与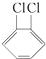
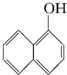 与
与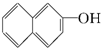
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取20.00 g NaOH固体 | |
| B. | 向用水润湿的pH试纸上滴盐酸,可测定盐酸的pH | |
| C. | 用电子分析天平测得铁片质量是15.524 g | |
| D. | 在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
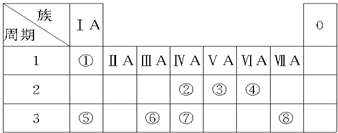
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
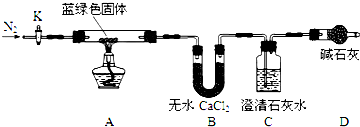
| 溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com