
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2(g) +![]() O2(g) = H2O(l)��H = ��285.8 kJ / mol
O2(g) = H2O(l)��H = ��285.8 kJ / mol
��C(s) + O2(g) = CO2(g)��H = ��393.5 kJ / mol
��C(s) + H2O(g) = CO(g) + H2(g)��H = ��131.5 kJ��mol
��ش�
��1��������Ӧ�����ڷ��ȷ�Ӧ����______������ţ���ͬ�����������ȷ�Ӧ����____��
��2��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ____kJ��
��3��д�����з�Ӧ���Ȼ�ѧ����ʽ
��1molN2(g)������O2(g)��Ӧ����NO(g)��������68 kJ��������
_______________________________________________
��2 molCu(s) ������O2(g)��Ӧ����CuO(s)���ų�314 kJ������
_______________________________________________
���𰸡��٢� �� 285.8 N2(g)+![]() O2(g)= NO(g) ��H=+68kJ/mol 2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol
O2(g)= NO(g) ��H=+68kJ/mol 2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol
��������
��1����H>0Ϊ���ȷ�Ӧ����H<0Ϊ���ȷ�Ӧ�������ڷ��ȷ�Ӧ���Ǣ٢ڣ��������ȷ�Ӧ���Ǣۣ�
��2����H2(g) +![]() O2(g) = H2O(l)��H = ��285.8 kJ / mol��֪��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ285.8 kJ��
O2(g) = H2O(l)��H = ��285.8 kJ / mol��֪��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ285.8 kJ��
��3����д�Ȼ�ѧ����ʽʱ��Ҫ��������ʵľۼ�״̬��ע����H����ֵ����λ����Ӧ��ϵ�������ʵ��������ⲻ�ñ����Ӧ�������������⣬��д���Ȼ�ѧ����ʽ��
��N2(g)+![]() O2(g)= NO(g) ��H=+68kJ/mol��
O2(g)= NO(g) ��H=+68kJ/mol��
��2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() Ư��
Ư��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Դ����������Ч����CO2���ŷţ��������̼��Դ��
��1��ȫ���ů����ܿ����Ǵ����е��������壨��CO2���ۼ���ɵġ��п�ѧ��������Խ�CO2ͨ���ܵ����͵����ף������ɼ���������CO2Ũ�ȵ����ӡ������й�˵����ȷ����__������ĸ����
A���͵�����Խ��ĵط���CO2�ܽ��Խ�࣬ͬʱCO2����Һ��������ɸɱ�
B����CO2���͵����ף���ʹ��ˮ������ǿ�������ں�����̬����
C����CO2���͵����ף������������������CO2Ũ���������ʵ�Ψһ�취
D��Ҫ����������CO2Ũ�ȵ����ӣ�����Ч�Ĵ�ʩ��ʹ������Դ��ֲ������
��2����֪����CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-890kJ��mol-1
��2H2(g)+O2(g)=2H2O(l) ��H=-572kJ��mol-1
��ӦCO2(g)+4H2(g)=CH4(g)+2H2O(l) ��H=__kJ��mol-1��
��3��CO2������ϳɶ�������CO2ת����һ�ַ�������Ҫ�������з�Ӧ��
��Ӧ��CO2(g)+H2(g)=CO(g)+H2O(g) ��H=+41.2kJ��mol-1
��Ӧ��2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ��H=-122.5kJ��mol-1
��һ���Ϊ1L�ĺ����ܱ������У�����1molCO2��1molH2��CO2��ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ�������¶ȵı仯������ͼ��ʾ�����У�CH3OCH3��ѡ����=![]() ��100%��
��100%��
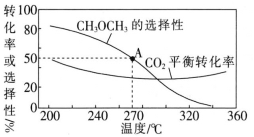
��CH3OCH3��ѡ�������¶ȵ����߶����͵�ԭ����___��
��270��ʱ�����ƽ��ʱCH3OCH3�����ʵ���Ϊ0.1mol����ʱ��Ӧ��Ļ�ѧƽ�ⳣ��K=__������2λ��Ч���֣���
��4���ྦྷCu��ĿǰΨһ��ʵ��֤ʵ�ܸ�Ч��CO2��ԭΪ���ࣨ��C2H4���Ľ��������װ���зֱ��ԶྦྷCu�Ͳ�Ϊ�缫���ϣ��������ӽ���Ĥ�ָ������������ң����������ҵ�KHCO3��Һ��Ũ�ȣ�Լ0.1mol��L-1���ң��������ֲ��䡣����ij�����ڳ���ͨ��CO2���¶ȿ�����10�����ҡ�ͨ��CO2�ĵ缫Ϊ___�������������������������C2H4�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz������ռ������ʵ��װ�ã���װ���ʺ���( )

A.��Ũ������Cu��Ӧ��ȡNO2B.��Ũ�����MnO2��Ӧ��ȡCl2
C.��H2O2��Һ��MnO2��Ӧ��ȡO2D.��NH4Cl��Ca (OH)2��Ӧ��ȡNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
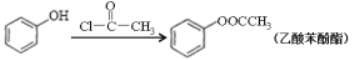
����Ŀ����ϩ�����ںϳ�Ӧ�ù㷺��DAP��֬����;�̼���������з�Ӧ�����еķ�Ӧ�����Ͳ��ָ�������ʡ�ԡ�
��֪����RCOOR��+R��OH��RCOOR��+R��OH(R��R����R����������)
��
III.����D��F�Ĺ����У����ַ�Ӧ��ı�ֵ����ͬ
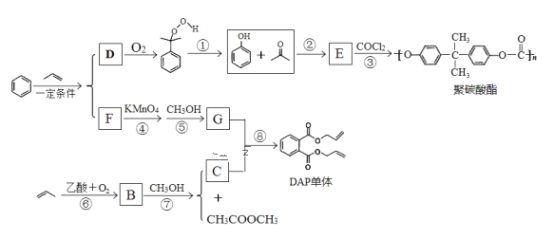
��ش��������⣺
��1����̼�����ķ���ʽΪ_______________����Ӧ�۵ķ�Ӧ����________________��
��2��E�Ľṹ��ʽ______________��B�����������ŵ�������___________��
��3������˵����ȷ����_______��
a��C�ܷ����ۺϷ�Ӧ���ӳɷ�Ӧ��������Ӧ
b��E����FeCl3��Һ������ɫ��Ӧ���������Ҵ�
c��D������ˮ������ѧ��Ӧ��ʹ��ˮ��ɫ��Ҳ��ʹ���Ը�������Һ��ɫ
d��COCl2��![]() �ṹ���ƣ��������ʵ�����ԭ�Ӿ���ƽ��
�ṹ���ƣ��������ʵ�����ԭ�Ӿ���ƽ��
��4��д����Ӧ��Ļ�ѧ����ʽ_________________��
��5��д��ͬʱ�����������������ᱽ����������ͬ���칹��Ľṹ��ʽ_________________���ּ���)��
�����ܷ���������Ӧ�����������ϵ�һ�ȴ��������֡�
��6��������ά��Ŀǰ������ߵ�һ�ֺϳ���ά���仯ѧ����Ϊ�۶Ա��������Ҷ��������������ϩ�ͱ�Ϊԭ�� �Ʊ�����֬�ĺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ��ע���Լ��ͷ�Ӧ������__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɡ�λ�������һ���Ʊ���������:
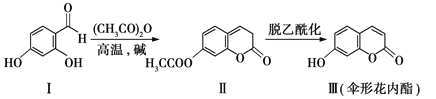
����˵������ȷ����
A.�������������ܷ���ˮ�ⷴӦ
B.��������������ʹ��ˮ��ɫ
C.���黯���������Ƿ���л�������������FeCl3��Һ
D.�뻯���������������ࡢ��Ŀ����ͬ�Һ��б�����ͬ���칹����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������18molL��1��Ũ�����м������ͭƬ�����ȣ�����ԭ����������ʵ���Ϊ0.9mol����Ũ�����ʵ�����Ϊ�� ��
A������50 mL B������50 mL C������100 mL D������100 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У�������ȷ���ﷴӦ��ɫ�仯����( )
A.����ˮ��ͨ��SO2���壬��Һdz����ɫ��ʧ��Cl2 + SO2 + 2 H2O = 4H+ + 2Cl- + SO42-
B.��AgNO3��Һ�м���һ����HCl��Һ�������Na2S��Һ����ɫ�������ɫ��2AgCl + S2- = Ag2S + 2Cl-
C.���������������м���HI����Һ�����ȳ��ֺ��ɫ�������������ʧ����Һ��Ϊ��ɫ��2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O
D.��CrO42-�м���H2SO4��Һ����ɫ�ɻ�ɫ��Ϊ��ɫ��2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����Fe3+��I-��ķ�Ӧ̽��������ԭ��Ӧ������ƽ���ƶ�ԭ����ȡϵ���ش��������⣺
��1����Fe2(SO4)3��������100mL0.05mol/L����Һ������ʱ���Ȱ�Fe2(SO4)3�����ܽ��ڽ�Ũ�����У�����ˮϡ�ͣ����������Ŀ����_______����ϻ�ѧ����ش�����
��2������ͬѧ��0.10mol/L��KI��Һ��0.05 mol��L-1 Fe2(SO4)3��Һ��5mL��ϳ�ַ�Ӧ����Һ��Ϊ�ػ�ɫ���ֽ�������ʵ��٢� ��

ʵ����в�����ɫ���������ӷ���ʽΪ_________���������Ϸ�Ӧ����д������ͬѧʵ���е����˷���ʽ_________���ڼ���ͬѧ�ķ�Ӧ�У�I2��Fe3+��������ǿ��˳��Ϊ_________��
�������ϣ�����������ͬʱ�����ʵ������Լ���ԭ��ǿ����Ũ�ȴ�С�����仯��
��3������ͬѧ����ͼʵ��װ�ý�һ��̽��������Ӧ��

K�պ�ʱ��ָ�뷢��ƫת�������е���������______��(����a������b���������ƶ�����ָ�����ʱ�����ձ�I������0.01mol/L AgNO3��Һ��ָ�뷴��ƫת������ƽ�ⷢ�����ƶ����ݴ˷���I-��ԭ��ǿ����Ũ�ȹ�ϵ______________��
��4������ͬѧ���ⶨ����ͬѧ�����ػ�ɫ��Һ��c(I2)����֪I2+2Na2S2O3=2NaI+Na2S4O6���ֽ�������к͵ζ������������cmol��L-1��Na2S2O3��Һ�������Ի����¶Ը���Һ���еζ�������Na2S2O3��ҺVmL��
��Na2S2O3��Һװ��______(������ʽ��������ʽ�����ζ��ܣ�ѡ�õ��ۼ�ҺΪָʾ�����ζ��յ�����Ϊ_______________��
����ʦ�������ͬѧ���������У�ԭ��һ��Fe3+��������Na2S2O3������_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com