

 =0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,物质的量为
=0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,物质的量为 =0.1mol,所以则Na2CO3与Na2SO3的物质的量之比为0.1mol:0.1mol=1:1,实验前后称量盛有干燥剂的E质量,求出质量差即可获得4.4g;
=0.1mol,所以则Na2CO3与Na2SO3的物质的量之比为0.1mol:0.1mol=1:1,实验前后称量盛有干燥剂的E质量,求出质量差即可获得4.4g;

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?丹东模拟)为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(2012?丹东模拟)为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
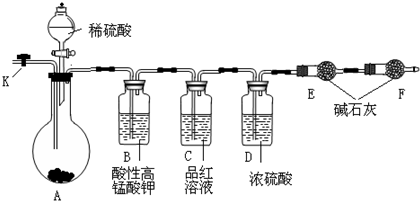
(14分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
⑴仪器F的作用是 。
⑵已知仪器C中装有品红溶液,其作用是 ,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是 。
⑶实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙,请将下列容器中应盛放的试剂序号填入相应空格:B中 ,D中 ,E中 。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”,“偏低”或“没影响”)。
⑷若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_______,其中4.4g数值获得的方法是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com