
【题目】下列物质中,不属于电解质的是
A.NaOHB.蔗糖C.H2SO4D.NaCl
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2,二硫化亚铁)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)对反应NH3+O2—NO+H2O(未配平,反应条件略去)作分析,该反应中,还原剂是_______,还原产物是________,被还原的物质是_________。参加反应的氧化剂为3.2g时,反应转移的电子的物质的量为________________。
(3)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
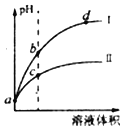
A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Ⅵ)的化合物有较大毒性,如不回收利用,会对环境造成污染。某混合浆液含Al(OH)3、MnO2和少量Na2CrO4。某研究小组设计了如下电解分离装置,可以使浆液较完全地分离成固体混合物和含铬元素溶液,并回收利用。下列说法错误的是( )
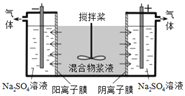
A. 通电后CrO42-将通过阴离子膜进入阳极室 B. 阴极室最终只能得到Na2SO4和H2
C. 阳极的电极反应式为:4OH--4e-=O2↑+2H2O D. 分离后所得含铬元素的粒子有CrO42-和Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
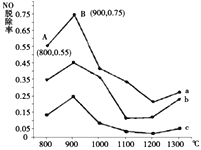
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中有0.2mol XO4﹣ , 加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4 , 则还原产物中X的化合价为( )
A.0
B.+1
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:
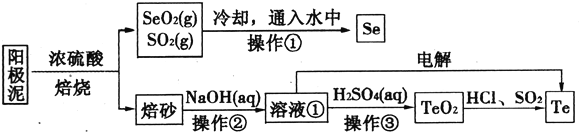
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
Ⅲ.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)NaHTeO3的溶液的pH____7(填“>”、“=”或“<”)。
(2)SeO2与SO2通入水中反应的化学方程式为________。操作①的名称为__________。
(3)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为____________。
(4)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是________________________。
(5)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________。
(6)上述流程中可循环利用的物质有__________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com