
 (1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)
(1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].) ;
;| 16×36.5×15.8 |
| 2×158 |
| 10 |
| 16 |
 ;18.25.
;18.25.


科目:高中化学 来源: 题型:
| A、催化剂能降低正反应的活化能,但不能改变逆反应的活化能 |
| B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知金刚石比石墨稳定 |
| D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13C与14C互为同位素,化学性质相同,但相对原子质量一定不同 |
| B、某元素原子次外层电子数是最外层电子数的2倍,则该元素氧化物为酸性氧化物 |
| C、IA族元素与VIIA元素形成的化合物都为离子化合物 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
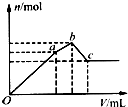 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| B、快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)做成 |
| C、使用的卫生纸都是再生纸 |
| D、把世博会期间产生的垃圾焚烧或深埋处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液与稀盐酸 |
| B、CuSO4溶液与BaCl2溶液 |
| C、稀H2SO4与NaCl溶液 |
| D、稀HNO3与Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com