
【题目】下列化合物中与自身类别相同的同分异构体数目(不考虑立体异构)最多的是( )
A. 戊烷 B. 戊醇 C. 戊烯 D. 戊炔
【答案】B
【解析】
自身类别相同的同分异构体要从碳链异构、位置异构角度分析考虑来解答。
A.戊烷只存在碳链异构,同分异构体为:CH3-CH2-CH2-CH2-CH3,![]() ,
,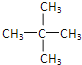 ,共3种;
,共3种;
B.戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、![]() 、
、 ,主链上有五个C原子的醇有3种:CH3CH2CH2CH2CH2OH、
,主链上有五个C原子的醇有3种:CH3CH2CH2CH2CH2OH、![]() 、
、![]() ;主链上有四个碳的有4种:
;主链上有四个碳的有4种:![]() 、
、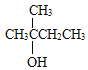 、
、![]() 、
、![]() ;主链三个碳的有1种:
;主链三个碳的有1种: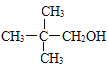 ,共有8种同分异构体;
,共有8种同分异构体;
C.戊烷的同分异构体有:CH3CH2CH2CH2CH3、![]() 、
、 ;若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2=CH-CH2-CH2-CH3、CH3-CH=CH-CH2-CH3;
;若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2=CH-CH2-CH2-CH3、CH3-CH=CH-CH2-CH3;
若为![]() ,相应烯烃有3种:CH2=C(CH3)CH2CH3;CH3C(CH3)=CHCH3;CH3CH(CH3)CH=CH2;若为
,相应烯烃有3种:CH2=C(CH3)CH2CH3;CH3C(CH3)=CHCH3;CH3CH(CH3)CH=CH2;若为 ,没有相应烯烃;共5种同分异构体;
,没有相应烯烃;共5种同分异构体;
D.戊炔的同分异构体为HC≡C-CH2CH2CH3、CH3C≡C-CH2CH3、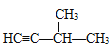 3种同分异构体;
3种同分异构体;
可见产生同类物质同分异构体种类数目最多是是戊醇,故合理选项是B。


科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称: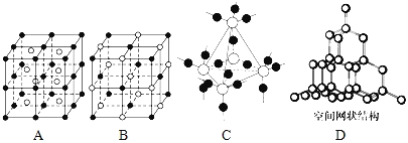
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(4)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______,G_______。
(2)写出F的价电子排布图:_______。
(3)写出化合物BC的结构式:__________________。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)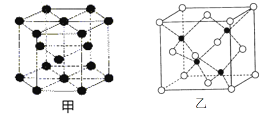
查看答案和解析>>
科目:高中化学 来源: 题型:
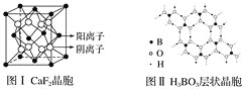
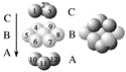
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空(所涉及元素均为前20号)
(1)A元素的原子M层有5个电子,则其原子结构示意图为__________________;最高价氯化物的化学式_______________________。
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,请写出C离子的结构示意图和电子式:________________、_________。
(3)标出下列反应的电子转移方向和数目,并填写有关内容:
KClO3+6HCl→3Cl2↑+3H2O+KCl、___________
氧化剂______________;氧化产物______________;还原剂______________;还原产物______________;被氧化的元素______________;HCl的作用______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,且离子具有相同的电子层结构。X的一种单质可杀菌消毒。W原子的最外层电子数与最内层电子数相等。下列说法不正确的是
A. 原子半径r(Z)>r(W)>r(X)>r(Y)
B. X的简单氢化物热稳定性比Y的强
C. 四种元素常见单质中,Y2的氧化性最强
D. X能与Z形成Z2X2,该化合物中含离子健和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究水样中污染物X在不同影响因素下的分解速率,测得X的物质的量浓度(![]() )随时间(min)变化的实验数据如下:
)随时间(min)变化的实验数据如下:
温度 | 时间 浓度 水样 | 0 | 10 | 20 | 30 | 40 |
| I | 0.80 | 0.68 | 0.60 | 0.56 | 0.54 |
| II | 1.60 | 1.34 | 1.20 | 1.08 | 1.02 |
| III | 1.60 | 1.26 | 1.08 | 0.94 | 0.94 |
下列说法不正确的是
A. ![]() 温度下水样I中,
温度下水样I中,![]() 之间X分解的平均反应速率为
之间X分解的平均反应速率为![]()
B. ![]() 温度下水样Ⅱ中,
温度下水样Ⅱ中,![]() 时X的浓度小于
时X的浓度小于![]()
C. ![]() 温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为
温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为![]()
D. 由表中数据推测,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com