
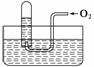
 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体是 ( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体是 ( )
A.可能是N2与NO2的混合气体
B.只能是O2与NO2的混合气体
C.可能是NO与NO2的混合气体
D.只能是NO2一种气体
科目:高中化学 来源: 题型:
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
 |
海藻 海藻灰 悬浊液 含I-的溶液 X Y 碘
 某化学兴趣小组将上述流程②③设计如下图:
某化学兴趣小组将上述流程②③设计如下图:
② ③
回答下列问题:
(1)写出提取过程①③中实验操作名称:① ③ 。
(2)写出过程②中有关反应的离子方程式:_____________________________________。
(3)过程③的F的下层液体的颜色为_____色,上层液体中溶质的主要成分为_________。
(4) 在灼烧过程中,将使用到的(除泥三角外)硅酸盐质实验仪器有________________(填代号,限填两项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架 E.酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某兴趣小组用如图装置做了两次实验。
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通氧气,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。
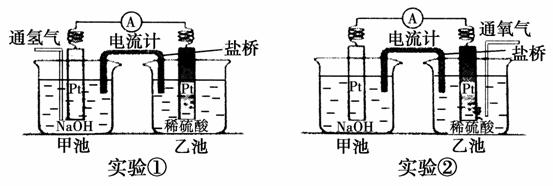
(1)实验①,甲池通氢气的Pt电极为________________极,电极反应式为_________________________________________________。
(2)实验②,乙池通氧气的Pt电极为________________极,电极反应式为__________________________________________________。
(3)两次实验中原电池的总反应相同,总反应的离子方程式为___
__________________________________________________________。

Ⅱ.电解法污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀、撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
(1)在电解处理过程中,若污水中离子浓度较小,导电能力较差,处理效率下降,此时可向污水中加入适量的________。
a.BaSO4 b.CH3COOH
c.NaNO3 d.CH3OH
(2)电解处理过程中,阳极实际发生了两个电极反应,阳极的电极反应式分别是①________________;②________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的A(g)与B(g)在密闭容器中进行反应:A(g)+B(g)2C(g)+D(s) ΔH<0,下列叙述正确的是( )
A.达到平衡后,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO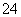 、NO
、NO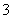
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO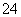
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求写出下列反应的离子方程式:
(1)在NH4Cl溶液中加入NaOH溶液,并加热
________________________________________________________________________。
(2)在NH4Cl溶液中滴加NaOH溶液
________________________________________________________________________。
(3)NH4Cl溶液呈酸性的原因
_____________________ ___________________________________________________。
___________________________________________________。
(4)在饱和NH4Cl溶液中滴加Na[Al(OH)4],产生刺激性气味的气体和白色沉淀
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是 ( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
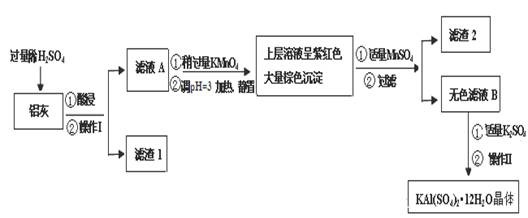 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnS04发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com