
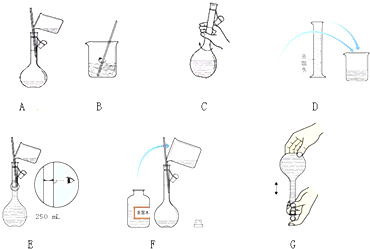
分析 (1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管;
(2)a.用电子天平称量质量为应为0.1×0.1×216=2.16g;
b.称量的FeBr2放入烧杯中;
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中;
d.容量瓶不能储存溶液;
e.定容时,仰视容量瓶刻度线会使溶液体积偏大.
解答 解:(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管,则除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100ml的容量瓶;
故答案为:玻璃棒、100ml的容量瓶;
(2)a.用电子天平称量质量为应为0.1×0.1×216=2.16g,故a错误;
b.称量的FeBr2放入烧杯中,不能放入容量瓶中,加90nL蒸馏水溶解,故b错误;
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中,故c正确;
d.容量瓶不能储存溶液,故d错误;
e.定容时,仰视容量瓶刻度线会使溶液体积偏大,浓度偏低,故e错误;
故选:abde.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大,试题培养了学生的分析能力及化学检验能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
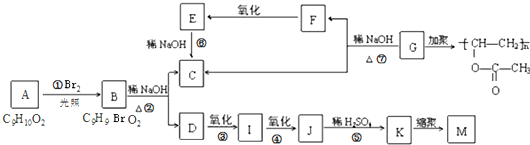
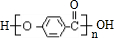 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
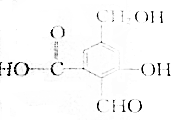 .
.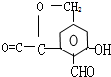 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
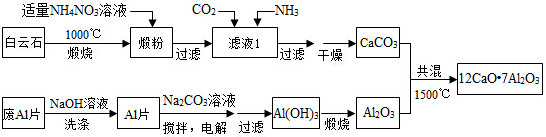
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
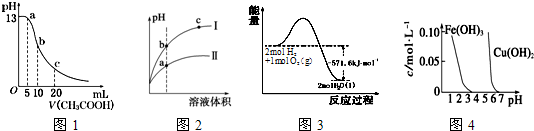
| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
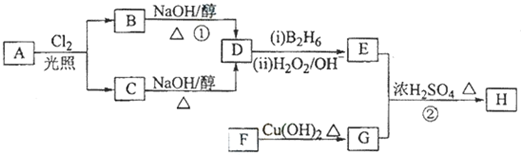
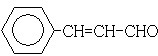 ;
;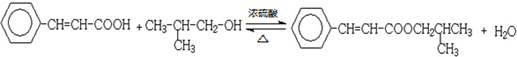 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com