
���� ��1��ͭ��Ũ������ȷ�Ӧ��ϡ�����Ӧ���ʲ�������ӦС������ֵ��
��2��ͭ�����ᷴӦ�����Ļ�ԭ�����������Ũ���йأ��淴Ӧ�Ľ��У�Ũ�����Ϊϡ���ᣬ�ʵõ���ͬ����Ļ�����N�غ���ȷ������ԭ������������ü�ֵ�����غ㷨��ȷ��û����ԭ���������
��3������������ͭ��Ӧ��������������ͭ��Ӧ������˫��ˮ�������ǽ�����ͭ����ΪCuO��Ȼ������ͭ�������ᣮ
��� �⣺��1����100mL 18mol•L-1��Ũ�����к���������ʵ���Ϊ��0.1L��18mol•L-1�T1.8mol
ͭ��Ũ���ᷴӦ�ķ���ʽΪ��
Cu+2H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
2mol 22.4L
1.8mol V
V=$\frac{1.8mol��22..4L}{2mol}$�T20.16L������ͭ��ϡ�����Ӧ����ʵ���ϲ������������С��20.16L��
��ѡ��D��
��2��ͭ��Ũ���ᷴӦ���������������淴Ӧ���У������ϡ����ϡ���ᷴӦ����һ�����������ռ�����Ϊ���ߵĻ����ʴ�Ϊ��NO2��NO��
�����������Ϊ�����֣�����ԭ�����û����ԭ���ᣮ����ԭ����ɸ���N�غ�ã�n��HNO3���Tn��NO2+NO���T1.12L��22.4L/mol�T0.05mol��û����ԭ������ɸ��ݵ���غ���÷�Χ��
��ֻ����������������ͭʧ������Ϊ��0.05mol����5-4���T0.05mol��ͭʧ��������������õ���������û����ԭ������Ϊ0.05mol��
��ֻ����һ����������ͭʧ������Ϊ��0.05mol����5-2���T0.15mol��ͭʧ��������������õ���������û����ԭ������Ϊ0.15mol��
���û����ԭ���������0.05��0.15mol֮�䣬�ʲμӷ�Ӧ���������0.10��0.20mol֮�䣬
��ѡ��C��
��3������������ͭ��Ӧ��������������ͭ��Ӧ������˫��ˮ�������ǽ�����ͭ����ΪCuO��Ȼ������ͭ�������ᣬ��Ӧ�ķ���ʽΪCu+H2O2+2HCl=CuCl2+2H2O��
�ʴ�Ϊ��Cu+H2O2+2HCl=CuCl2+2H2O��
���� ���⿼����Ũ�������������ʣ�Ҫע��Ũ�Ȳ�ͬ�����ﲻͬ���й�������ԭ��Ӧ�ļ��㳣�����غ㷨�����㣮�ر���ͬ�ַ�Ӧ�����ͬ�ķ�Ӧ����ʱ����ֵ��Ҳ�ǻ�ѧ�����г��õķ������������ǵĻ�ѧ�����ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
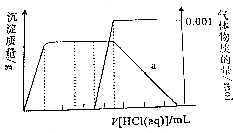 ij��Һ��ֻ���ܺ���CO32-��AlO2-��Fe3+��Na+��SiO32-��NH3•H2O�еļ������ӣ���������£����ϵ���ϡ���ᣬ����ʵ��������������ͼ����Ը���Һ�������ж���ȷ���ǣ�������
ij��Һ��ֻ���ܺ���CO32-��AlO2-��Fe3+��Na+��SiO32-��NH3•H2O�еļ������ӣ���������£����ϵ���ϡ���ᣬ����ʵ��������������ͼ����Ը���Һ�������ж���ȷ���ǣ�������| A�� | ��Һ�ʼ��ԣ�һ������Fe3+����NH3•H2O��c��CO3 2-�� Ϊ0.001mol/L | |
| B�� | ��H+��Ӧ���Ⱥ�����ǣ�AlO2-��NH3•H2O��CO32-��HCO3-��A l��OH��3 | |
| C�� | һ������CO32-��AlO2-��Na+��NH3•H2O������ ����SiO32- | |
| D�� | a����Һ�д��ڣ�c��Na+��+c��H+��+3c��Al3+��=c��OH-��+c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
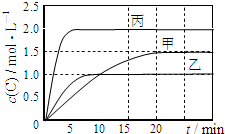 ��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+xB��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����������ͼ��ʾ��
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+xB��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����������ͼ��ʾ��| ���� | �� | �� | �� |
| �ݻ� | 0.5L | 0.5L | 1.0L |
| �¶�/�� | T1 | T2 | T2 |
| ��Ӧ�� ��ʼ�� | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A�� | x=1 | |
| B�� | 10min���������з�Ӧ��ƽ������v��B��=0.025mol•L-1•min-1 | |
| C�� | ��ͼ��֪��T1��T2���Ҹ÷�ӦΪ���ȷ�Ӧ | |
| D�� | T1�棬��ʼʱ�������г���0.5molA��1.5molB��ƽ��ʱA��ת����Ϊ75% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���0.2mol•L-1 Al2��SO4��3��Һ�У���μ���1.0mol•L-1 NaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯������ͼ�������й�˵��������ǣ�������
�����£���0.2mol•L-1 Al2��SO4��3��Һ�У���μ���1.0mol•L-1 NaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯������ͼ�������й�˵��������ǣ�������| A�� | a��ʱ����Һ�����Ե�ԭ���ǣ�Al3++3H2O?Al��OH��3��+3H+ | |
| B�� | b��c�Σ������NaOH��Ҫ��������Al��OH��3���� | |
| C�� | c�䡫d�Σ���Һ�Լ��Ե�ԭ���ǣ�NaOH�TNa++OH- | |
| D�� | d��e�Σ������ķ�ӦΪ��Al��OH��3+NaOH�TNaAlO2+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�33.6L�������к��з�ԭ�ӵ���ĿΪ1.5NA | |
| B�� | ���³�ѹ�£�7.0g��ϩ���ϩ�Ļ�����к���̼�������ĿΪNA | |
| C�� | 50 mL18.4mol/LŨ����������ͭ�ȷ�Ӧ������S02���ӵ���ĿΪ0.46NA | |
| D�� | ij�ܱ�����ʢ��0.1mol N2��0.3mol H2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0 6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���渻�й��� | B�� | �пɳɼ��ĵ��� | ||
| C�� | �н������� | D�� | �������˶��ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
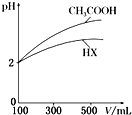 ˮ��������ԴȪ����ҵ��ѪҺ�����е���������ش��������⣺
ˮ��������ԴȪ����ҵ��ѪҺ�����е���������ش��������⣺| ��ѧʽ | ���볣����25�棩 |
| HCN | K=4.9��10-10 |
| CH3COOH | K=1.8��10-5 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������BaSO4 | B�� | һ����BaSO3 | ||
| C�� | һ����BaSO4 | D�� | һ����BaSO3��BaSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 26 | B�� | 28 | C�� | 22 | D�� | 24 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com