
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
方案一:
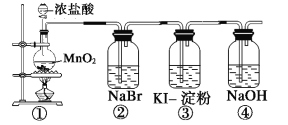
(1)根据方案一装置回答以下问题:
写出装置①发生的化学反应方程式:___。若将反应后②中的溶液倒入苯中,振荡静置后,出现的现象与如图吻合的是___。(填代号)装置③中的现象是___。

(2)根据方案二装置回答以下问题:
方案二:

方案二验证元素非金属性递变的理论依据是:___。B装置的作用是___,X试剂是___。
【答案】MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O C 溶液变蓝色 元素的非金属性越强,其最高价氧化物对应水化物的酸性越强 吸收CO2中的HCl 饱和NaHCO3溶液
Cl2↑+MnCl2+2H2O C 溶液变蓝色 元素的非金属性越强,其最高价氧化物对应水化物的酸性越强 吸收CO2中的HCl 饱和NaHCO3溶液
【解析】
(1)装置①中发生的是浓盐酸和二氧化锰反应生成氯化锰、氯气和水,若将反应后②中的溶液倒入苯中,溴单质和苯互溶,苯密度比水小,因此出现溶液分层,下层为无色,上层为橙红色,装置③中的现象是单质碘使淀粉溶液变蓝;
(2)方案二验证元素非金属性递变的理论依据是:元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强酸制弱酸),A中生成二氧化碳,但含有易挥发的HCl,因此B装置的作用是除掉挥发出的HCl杂质,一般用饱和碳酸氢钠;据此分析解答。
(1)装置①中发生的是浓盐酸和二氧化锰反应,其化学方程式MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O,若将反应后②中的溶液倒入苯中,生成的溴单质和苯互溶,苯的密度比水小,因此出现溶液分层,下层为,上层为橙红色,则出现的现象与图中吻合的是C,生成的Cl2进入装置③中,将KI中的I-氧化成I2,使得淀粉溶液变蓝,故答案为:MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O,若将反应后②中的溶液倒入苯中,生成的溴单质和苯互溶,苯的密度比水小,因此出现溶液分层,下层为,上层为橙红色,则出现的现象与图中吻合的是C,生成的Cl2进入装置③中,将KI中的I-氧化成I2,使得淀粉溶液变蓝,故答案为:MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O;C;溶液变蓝色;
Cl2↑+MnCl2+2H2O;C;溶液变蓝色;
(2)方案二验证元素非金属性递变的理论依据是:元素的非金属性越强,最高价氧化物对应水化物的酸性越强,酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强酸制弱酸),A中生成二氧化碳,但含有易挥发的HCl,因此B装置的作用是除掉挥发出的HCl杂质,X是饱和碳酸氢钠,主要避免二氧化碳损失,故答案为:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强;吸收CO2中的HCl;饱和NaHCO3溶液。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】(14分)为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
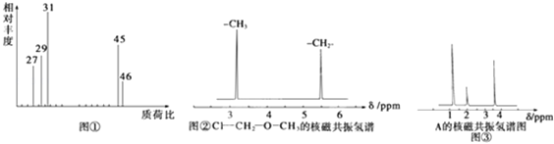
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是 .
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为 ,该物质的分子式是 .
(3)根据价键理论,预测A的可能结构并写出结构简式 、 .
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为 .
(三)性质实验:
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学方程式: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物6g完全燃烧,生成![]() 和
和![]() (标准状况下),0.5mol此有机物的质量为30g。
(标准状况下),0.5mol此有机物的质量为30g。
(1)通过计算确定该有机物的分子式:_________(写出必要的计算过程)
(2)该有机物有有多种同分异构体。其一能使紫色石蕊试液变红,则该有机物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
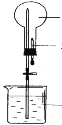
A.a为HCl,b为H2O
B.a为SO2,b为浓NaOH溶液
C.a为NH3,b为稀盐酸
D.a为Cl2,b为饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:
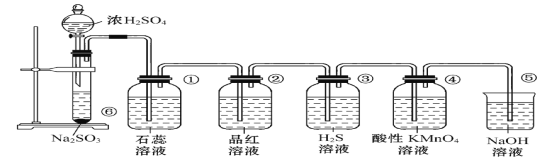
(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下两个反应,关于这两个反应的叙述错误的是( )
①2HCl![]() H2↑+Cl2↑ ②2HCl
H2↑+Cl2↑ ②2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
A.①②两反应都是氧化还原反应
B.①②两反应中的能量转换方式都是热能转变为化学能
C.①反应是热能转变为化学能
D.②反应是电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应N2(g)+3H2(g) ![]() 2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
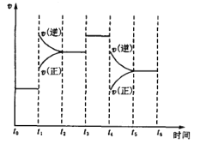
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为Fe(OH)3-3e-+H2OFeO42-+5H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
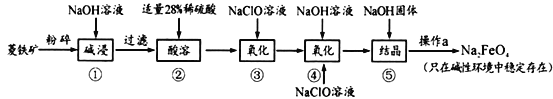
(1)Na2FeO4中铁元素的化合价为_____________,高铁酸钠用于杀菌消毒时的化学反应类型为_______________(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH___________ (填“能”或“不能”),理由是________________________。
(3)步骤③中检验Fe2+全部转化成Fe3+的方法是:___________________________。
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_____________。己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)生产过程中,理论上每获得0.5mol的FeO42-消耗 NaClO的总质量为_______________。
(6)已知几种物质在20℃时的Ksp如下表:
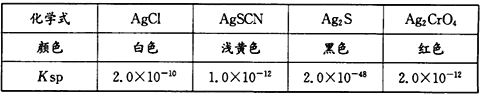
某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是_____(填编号)。
A.KCl B.KSCN C.K2S D.K2CrO4
若取晶体样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用cmol/LAgNO3溶液滴定至终点消耗标准溶液bmL。则x的表达式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com