
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
分析 阳离子放电顺序Cu2+>H+>Na+,阴极先发生:Cu2++2e-═Cu,后发生:2H++2e-═H2↑;阴离子放电顺序Cl->OH->SO42-,阳极先发生:2Cl--2e-═Cl2↑,后发生:4OH--4e-═2H2O+O2↑,电解质溶液中阳离子向阴极移动,阴离子向阳极移动.
解答 解:阳离子放电顺序Cu2+>H+>Na+,阴极先发生:Cu2++2e-═Cu,后发生:2H++2e-═H2↑;阴离子放电顺序Cl->OH->SO42-,阳极先发生:2Cl--2e-═Cl2↑,后发生:4OH--4e-═2H2O+O2↑.
A.阴极上有Cu析出,阳极质量增重,故A错误;
B.溶液中的Cu2+、H+和Na+都要移向阴极,阳离子放电顺序Cu2+>H+>Na+,在阴极优先放电的离子是Cu2+,故B正确;
C.溶液中的Cl-在阳极上完全放电后,溶液中OH-离子放电生成氧气,SO42-离子不放电,故C错误;
D.阴极先发生:Cu2++2e-═Cu,后发生:2H++2e-═H2↑,开始没有气体生成,故D错误,
故选:B.
点评 本题考查电解原理,明确离子放电顺序是解题关键,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.
扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.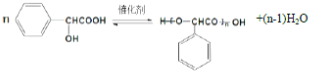 .
.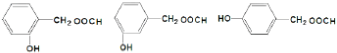 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
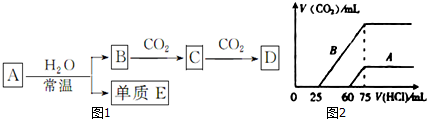
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
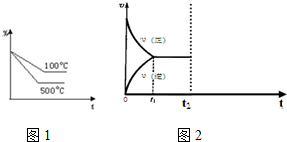
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g),升温时体系颜色加深说明正反应为吸热反应 | |
| B. | N2(g)+3H2(g)?2NH3(g),若升温时NH3的浓度减小,则平衡常数K增大 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g),升温时CO的转化率增大,说明正反应为吸热反应 | |
| D. | 反应2HI(g)?H2(g)+I2(g)达到平衡后,增大HI的物质的量,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨与O2反应 | B. | 硫磺与O2反应 | ||
| C. | 闪电时,氮气与O2反应 | D. | 硅在足量的O2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与Na2S03溶液加足量稀HNO3 | |
| B. | Ba(0H)2溶液与KN03溶液加足量稀H2SO4 | |
| C. | AgN03溶液与Na2C03溶液加足量稀盐酸 | |
| D. | Ca(0H)2溶液与FeCl3溶液加足量稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com