
��֪A��B��C��D��E��F�Ǻ���ͬһ��Ԫ�صĻ��������F��ʹʪ���ɫʯ����ֽ����ɫ������֮���ܷ������·�Ӧ��
��A��H2O��B��C ��C��F��D ��D��NaOH��F��E��H2O
��1��д��B�Ļ�ѧʽ_________��
��2����ҵ����C�Ĺ�����������һ����Ӧ����F������������B��H2O��д���ò���Ӧ�Ļ�ѧ����ʽ��____________________________��
��3��ijͬѧ��ͼʾװ�ã��̶����������������ԣ������й�F����ȡʵ��̽�����ش��������⣺
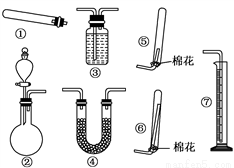
��i������װ�â���ȡF�����ռ�װ��Ϊ__________����װ����ţ���������Ӧ�Ļ�ѧ����ʽΪ______________________��
����������װ�â���ȡF����Һ©����ʢװ���Լ�Ϊ__________��Բ����ƿ��ʢװ���Լ�Ϊ______________������дһ�֣�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����и߶��ڶ��Σ�3�£�ѧҵˮƽģ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��д��ȷ����
A. ����������Fe2O3��6H��===2Fe3����3H2O
B. ̼���������Na2CO3��2H��===2Na����CO2����H2O
C. ��Ƭ���뵽����ͭ��Һ�У�2Fe��3Cu2��===2Fe3����3Cu
D. �������м���������ˮ��H����NH3��H2O===NH ��H2O
��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�����и�����ѧ�ڵ��ߴ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����֧�ֱ�ʢ����ɫ��Һ���Թܣ��������²�����������ȷ���ǣ� ��
���� | ���� | ���� | |
A | �μ���ˮ��CCl4�������� | �²���Һ���Ϻ�ɫ | ԭ��Һ����I- |
B | �μ�BaCl2��Һ | ���ɰ�ɫ���� | ԭ��Һ��һ����SO42- |
C | ��10mL 0.2mol/LNaOH��Һ���ȵ���2��0.1mol/LMgCl2��Һ���ٵμ�2��0.1mol/LFeCl3��Һ | ���а�ɫ�������ɣ�����FeCl3��Һ�����к��ɫ�������� | ����ͬ���¶��µ�Ksp: Mg(OH)2>Fe(OH)3 |
D | �μ�ϡNaOH��Һ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ��һ����NH4+ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡΫ���и�һ��ѧ�ڵ�һ���¿�ģ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A. SiH4��CH4�ȶ�
B. O2-�뾶��F-��С
C. Na��Cs���ڵڢ�A��Ԫ�أ�Csʧ����������Na��ǿ
D. P��As���ڵڢ�A��Ԫ�أ�H3PO4���Ա�H3AsO4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡΫ���и�һ��ѧ�ڵ�һ���¿�ģ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ� ��
A. �Ȼ�����Һ�м�������İ�ˮ��Al3+ + 4NH3��H2O =[Al(OH)4]��+4 NH4+
B. ����ʯ��ˮ���մ���Һ��ϣ�Ca2+ + CO32- = CaCO3��
C. Na[ Al(OH)4] ��Һ�м���������AlO2�� + H++ H2O= Al(OH)3��
D. �Ȼ�������Һ��ͨ��������2Fe2+ + Cl2 = 2Fe3+ + 2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����1LH2SO4��HNO3�Ļ����Һ����H2SO4��HNO3���ʵ���Ũ�ȴ������¹�ϵ��c(H2SO4)+c(HNO3)=1.2mol��L-1����������������ܽ�ͭ�����ʵ���Ϊ
A. 0.80mol 0.72mol B. 0.45mol C. 0.40mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪Ԫ�ص�����aAn+��bB(n+1)+��cCn-��dD(n+1)-������ͬ��������Ԫ���γɵļ����ӡ�����������ȷ���ǣ� ��
A. ԭ�Ӱ뾶: C > D > A > B B. ԭ��������C > D > B > A
C. ���Ӱ뾶��D > C > B > A D. ���ʵĻ�ԭ�ԣ�B > A > C > D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ�����и���һģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
����/H2O2��Һ����������������������
(1)��֪T��ʱ��2SO2(g)+O2(g)  2SO3(g) ��H1
2SO3(g) ��H1
2H2O2(I)=2H2O(I)+O2(g) ��H2
SO3(g)+H2O(I))=H2SO4(I) ��H3
��SO2(g)+H2O2(I))=H2SO4(I) ��H4=__________ (�ú���H1����H2����H3�Ĵ���ʽ��ʾ)
(2)����[CO(NH2)2]��Һ��NOx��SO2��һ�����ѳ��ʡ���SO2��NOx (N��Լռ90%)ͨ���������������Ϊ7%������Ũ��Ϊ5%�ķ�Ӧ���н��з�Ӧ��
��������SO2����ת��Ϊһ�����Σ��仯ѧʽΪ______________��NO��NO2�����ʵ���֮��1:1��CO(NH2)2��Ӧ����������Ļ�ѧ����ʽΪ_______________��
�ڰ��������(H2NCOONH4)�����ص�ˮ������һ�����İ�����������ں����ܱ������У�������Ӧ��NH2COONH4(s) 2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
�¶�/K | 338 | 343 | 348 | 353 |
ƽ��ʱ�������Ũ��/mol • L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
�÷�Ӧ�ġ�H__________(�>����<��)0��348Kʱ���÷�Ӧ��ƽ�ⳣ��K__________________��
(3)�����������䣬��������Һ������H2O2��Һ����ò�ͬ pH�µ���������ѳ�����ʱ��Ĺ�ϵ��ͼ��ʾ��
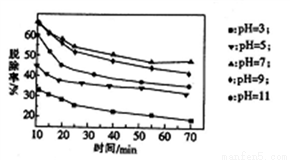
��NO��H2O2������Ӧ����������ʱ���������뻹ԭ�������ʵ���֮��Ϊ____________��
(2)����ʱ�����pHΪ_________���ڼ��Խ�ǿʱ��NOx�ѳ��ʽ��ͣ���ԭ����___________(��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ�����и����¸߿�ѡ����Ӧ�Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ����������ͨ��50mL 10.00mol��L-1����������Ũ��Һ�У���������ʱ�����Һ���γ�NaCl��NaClO��NaClO3������ϵ��������������ˮ�ķ�Ӧ��������˵����ȷ����
A. ����Ӧ��ת�Ƶĵ���Ϊnmol����0.25 < n < 0.5
B. ��Һ��n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ3
C. ��NaOH��Ӧ���������ʵ�����0.25 mol < n (Cl2) < 0.75mol
D. ����Һ��n(NaClO)��n(NaClO3) = 5��1ʱ����Ӧ�����ӷ���ʽΪ��8Cl2+16OH-=10Cl-+5ClO-+ClO3-+8H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com