
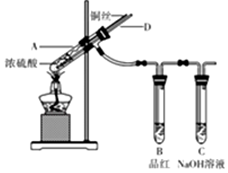
 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:分析 加热条件下,铜与浓硫酸发生氧化还原反应生成二氧化硫、硫酸铜和水,为控制反应的进行,可调节铜丝的高度,将Cu丝上提离开液面,反应即可停止,D管可通入空气,将试管内二氧化硫完全排尽,二氧化硫具有漂白性,可使品红褪色,氢氧化钠溶液用于吸收二氧化硫,防止污染空气,以此解答该题.
解答 解:(1)A中铜与浓硫酸在加热条件下反应生成二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中大量鼓气,
故答案为:从D管口向A中通入空气(鼓气);
(3)由于二氧化硫与溴单质发生反应:SO2+Br2+2H2O=4H++2Br-+SO42-,导致溴水褪色,该反应证明了二氧化硫具有还原性,无法证明二氧化硫具有漂白性,所以不同意该观点,
故答案为:不同意;SO2+Br2+2H2O=4H++2Br-+SO42-.
点评 本题考查了浓硫酸的化学性质、硫酸铜的制备等知识,为高频考点,题目难度中等,注意掌握浓硫酸的化学性质,把握实验的原理以及实验方法,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁俗名铁红,可用作红色涂料 | |
| B. | 氢氧化铝是两性氢氧化物,可用于治疗胃酸过多 | |
| C. | 铁是地壳中含量最多的金属元素 | |
| D. | 保存硫酸亚铁溶液常加铁粉防氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| B. | 将含有0.1mol FeCl3的饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| C. | 1mol/L的氯化钠溶液中,所含离子数为NA | |
| D. | 常温下,CO和N2混合物共2.8g,所含有的原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com