
��һ���¶��£�������X������Y��0��16mol����10L�����ܱ������У�������ӦX��g����Y��g�� 2Z��g����H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z��g����H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0��12 | 0��11 | 0��10 | 0��10 |
����˵����ȷ����
A����Ӧǰ2min��ƽ�����ʦͣ�Z��=2��0��10-3mol��L-1��min-1
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ�ͣ��棩>�ͣ�����
C�����¶��´˷�Ӧ��ƽ�ⳣ��K=1��44
D�������������䣬�ٳ���0��2molZ��ƽ��ʱX�������������
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | ||
| C | D |
| A�� | A��C��D������������Ӧˮ���������ǿ��˳��D��C��A | |
| B�� | B��C�γɵĻ������������ | |
| C�� | C����������B�������ӵĵ��Ӳ�ṹ��ͬ | |
| D�� | DԪ�ص�����⻯������ȶ��Դ���BԪ�ص�����⻯�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BF3 | B�� | NF3 | C�� | NH3 | D�� | PCl5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{m}{A+16}$��A-n+8��mol | B�� | $\frac{m}{A+16}$��A-n+10��mol | C�� | ��A-n+2��mol | D�� | $\frac{m}{A+16}$��A-n+6��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
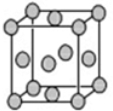
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
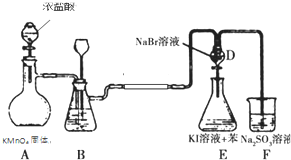
| A�� | F2������NaCl��Һ��Ӧ�û������� | |
| B�� | װ��B�п�ʢ��ˮ���������е�HCl���� | |
| C�� | װ��E�²�����Ϻ�ɫ | |
| D�� | װ��E���л��Լ�������Ϻ�ɫ����˵���ǽ�����Br��I |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и�����ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
A~G�����ʼ�Ĺ�ϵ����ͼ��ʾ������B��DΪ���嵥�ʡ�������˵���������
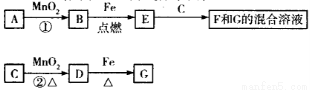
A����֪C��Ũ��Һ�ڴ������ڵ������¼��ȣ�����B��Ӧ����D���ɴ˿����ƶ�B�������Ա�MnO2ǿ
B����Ӧ�ڵ����ӷ���ʽΪ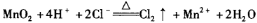
C�������Ƶ�F��Һһ����Ҫ������м��ϡ���ᣬǰ�����ڷ�ֹFe2+������������Fe3+�����߿�����Fe2+��ˮ��
D������Ӧ���ڳ����½��У���1molA�ڷ�Ӧ����ת��1mol����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com