
| A. | 溴水 | B. | NaHCO3溶液 | C. | 乙醇 | D. | 酸性KMnO4溶液 |
科目:高中化学 来源: 题型:选择题
| A. | 铁的晶胞中空间利用率为74% | |
| B. | 晶胞中配位数为12的金属,一定是面心立方最密堆积 | |
| C. | Zn的晶胞类型与铜相同 | |
| D. | 简单立方堆积的晶胞中原子配位数是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
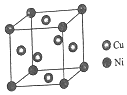 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和Li同一主族的都是金属元素 | B. | Na+比Li多一个电子层 | ||
| C. | Li、Na、K+的最外层都只有一个电子 | D. | Li是碱金属中原子半径最小的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 硫酸% | 31.52 | 36.10 | 40.67 | 45.25 |
| 锰浸出率 | 77.42 | 89.49 | 91.59 | 97.95 |
| 黄铁矿% | 12.5 | 15 | 17.5 | 20 |
| 锰浸出率 | 88.79 | 97.95 | 99.18 | 99.46 |
| A | 硫酸45.25% | B | 硫酸31.52% | C | 硫酸45.25% | D | 硫酸36.10% |
| 黄铁矿20% | 黄铁矿15% | 黄铁矿15% | 黄铁矿20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com