
(10分)SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案: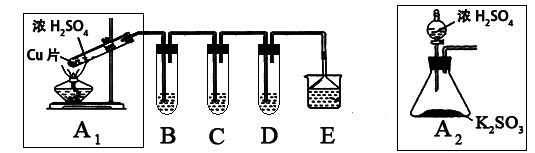
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
⑴品红溶液 (1分)
SO2 + I2 + 2H2O = SO42- +2I- + 4H+(2分,电荷不守恒0分;化学式任错一个0分)
⑵①不用加热,安全性能高。②易于控制反应进行,反应更充分。(任写一个,合理答案均给1分)实验操作 预期现象与结论 步骤2:滴入1滴(或少量)品红(1分),再滴入过量2mol/L盐酸,振荡(1分) 若品红褪色(或有气泡),则“吸收液”中存在 SO32-。(1分) 步骤3:用试管取适量滤液(1分),向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡(1分)。 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-。
(1分)
解析


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
 ① 写出亚铁离子的基态电子排布式 。
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
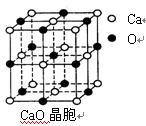
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点 NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒![]()
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。CO结构中σ键和П键数目之比为 ![]()
③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型),Fe元素的化合价 。
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如图所示,其中Ca2+周围的阴离子配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是 。

⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为 。
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。CO结构中σ键和П键数目之比为 。
③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型),Fe元素的化合价 。
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+周围的阴离子配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是 。
(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com