
| A. | c=$\frac{2000ρa}{M}$ | B. | a%=$\frac{c}{2000ρ}$ | C. | M=$\frac{1000ρa%}{c}$ | D. | $S=\frac{100cM}{2000ρ-cM}$ |
分析 A.计算c(X2SO4),根据c=$\frac{1000ρw}{M}$计算;
B.计算a%,根据c(X2SO4)=$\frac{1000ρw}{M}$=$\frac{1}{2}$c(X+)计算;
C.计算M,根据c(X2SO4)=$\frac{1000ρw}{M}$=$\frac{1}{2}$c(X+)计算;
D.依据a%及溶解度是一定温度下100g水溶解溶质达到饱和时的质量计算.
解答 解:A.c(X2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×ρ×a%}{M}$,故A错误;
B.由c(X2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×ρ×a%}{M}$=$\frac{1}{2}$c(X+)=$\frac{1}{2}$c,则a%=$\frac{Mc}{2000ρ}$,故B错误;
C.由c(X2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×ρ×a%}{M}$=$\frac{1}{2}$c(X+)=$\frac{1}{2}$c,则M=$\frac{2000ρa%}{c}$,故C错误;
D.由B得a%=$\frac{Mc}{2000ρ}$,又饱和溶液a%=$\frac{S}{100+S}$,所以$\frac{Mc}{2000ρ}$=$\frac{S}{100+S}$,解得S=$\frac{100cM}{2000ρ-cM}$,故D正确;
故选D.
点评 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数、溶解度等,注意掌握物质的量浓度与质量分数之间的关系,题目属于字母型计算,增大计算难度,为易错题目,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 乙醇是电解质 | 乙醇可与钠反应放出氢气 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 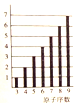 图纵坐标为元素的最高正价 | |
| B. |  图可说明反应2NO+2CO=N2+2CO2为吸热反应 | |
| C. | 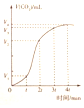 若图表示的是一定量的CaCO3与盐酸反应生成CO2的体积随时间的变化,则t~2tmin反应速率最快 | |
| D. | 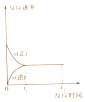 若图表示的是反应N2(g)+3H2(g)?2NH3(g)的.v(正)、v(逆)随时间的变化,则0~t1时间段:v(正)=v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧 | X |
| Y | Z |
| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液pH | |
| HX | HZ | ||
| ① | 0 | 3 | 1 |
| ② | 20.00 | a | 7 |
| A. | 表格中a<7 | |
| B. | HX和HZ等体积混合后pH=1+lg2 | |
| C. | Y和Z两元素的简单氢化物受热分解,前者分解温度高 | |
| D. | 0.l000 mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
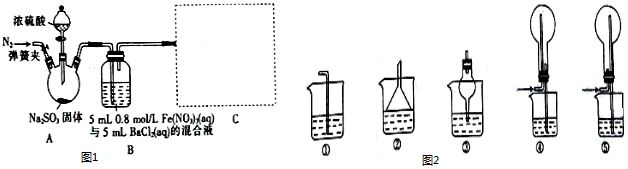
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com