
科目:高中化学 来源: 题型:
当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为____________________________________________________
_____________________________________________________________________
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:
①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式________________________________________
______________________________________________________________________。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是__________________________
_________________________________________________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碱金属的叙述正确的是( )
A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大
B.碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应
C.碳酸铯加热时不能分解为二氧化碳和氧化铯
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
有3份等质量的小苏打,第1份直接与盐酸恰好完全反应;第2份首先加热,使其部分分解后,再与盐酸恰好完全反应;第3份首先加热,使其完全分解后,再与盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列为各组指定的元素原子的价电子排布式,不能形成AB2型化合物的是( )
A.2s22p2和2s22p4 B.3s23p4和2s22p4
C.3s2和2s22p5 D.3s1和3s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18。根据结构填空:
(1)写出元素名称:A__________,B__________,C__________,D__________。
(2)D的简单离子是________。
(3)元素的氢氧化物碱性最强的是________。
(4)B与D两原子间形成化合物的化学式是______________。
(5)写出A、B的电离能顺序:________。
(6)写出C基态原子的电子排布式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
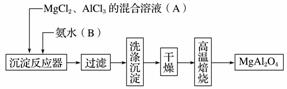
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
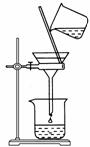
(2)如右图所示,过滤操作中的一处错误是________________。
(3)判断流程中沉淀是否洗净所用的试剂是__________________。高温焙烧时,用于盛放固体的仪器名称是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
(4)H2Se的酸性比H2S________(填“强”或“弱”)。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________________;
②H2SeO4比H2SeO3酸性强的原因:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com