
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe与氯气直接反应生成FeCl3;
B.NaOH与少量二氧化碳反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠;
C.氨气与氧气反应生成NO,NO与氧气反应生成二氧化氮;
D.过量的氢氧化钠和氯化铝溶液反应生成NaAlO2,NaA|lO2和AlCl3双水解反应生成Al(OH)3;
解答 解:A.Fe与氯气反应不能生成FeCl2,不符合图中转化,故A选;
B.NaOH与少量二氧化碳反应生成碳酸钠,CO2+2NaOH=Na2CO3+H2O,碳酸钠与二氧化碳反应生成碳酸氢钠,CO2+Na2CO3+H2O=2NaHCO3,符合图中转化,故B不选;
C.氨气与氧气反应生成NO,4NH3+O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,NO与氧气反应生成二氧化氮,2NO+O2=2NO2,符合图中转化,故C不选;
D.AlCl3+4NaOH+=NaAlO2+3NaCl+2H2O,3NaAlO2+AlCl3+H2O=4Al(OH)3↓+3NaCl,故D不选;
故选A.
点评 本题考查无机物的推断,侧重物质转化及物质性质的考查,明确常见物质的化学性质为解答的关键,注意知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酚酞试液 | B. | 紫色石蕊试液 | C. | AgNO3 溶液 | D. | NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
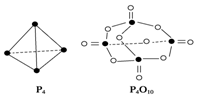 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
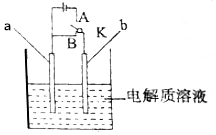 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200g63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1 盐酸和足量MnO2共热,转移的电子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为4NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
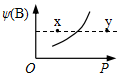 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com