
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组充分反应后铝的物质的量为0.01mol |
分析 对比甲乙数据,加合金质量为770mg时生气氢气比甲中多,说明甲中盐酸过量,对比乙丙数据,加918mg合金时氢气的体积不变,说明加入770mg合金时盐酸已完全反应,加入918g镁铝合金时,最多只能生成672mL的氢气,说明盐酸最多只能产生672mL的氢气,以此计算盐酸的浓度,用甲组来计算合金中的物质的量的比值并计算合金中镁或铝的物质的量.
解答 解:加入918g镁铝合金时,最多只能生成672mL的氢气,说明盐酸最多只能产生672mL的氢气,
所以就672mL来计算盐酸的物质的量,气体的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,
根据方程式,可计算出HCl的物质的量为0.03mol×2=0.06mol,
盐酸的物质的量浓度为:$\frac{0.06mol}{0.06L}$=1mol/L,
由于甲组中,盐酸是过量的,所以用甲组来计算,
设Mg的物质的量为x,Al的物质的量为y
生成气体的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol
依题意得:24x+27y=0.510g;x+$\frac{3}{2}$y=0.025mol
解方程组得:x=0.01mol;y=0.01mol,所以物质的量之比为1:1,
A.对比甲乙数据,加合金质量为770mg时生气氢气比甲中多,说明甲中盐酸过量,对比乙丙数据,加918mg合金时氢气的体积不变,说明加入770mg合金时盐酸已完全反应,故A错误;
B.由以上计算可知,盐酸的物质的量浓度为1mol/L,故B错误;
C.由以上计算可知,合金中镁铝的物质的量之比为1:1,故C正确;
D.由以上计算可知,合金中镁铝的物质的量之比为1:1,设918mg合金中Al和Mg的物质的量都为xmol,则24x+27x=0.918g,解得:x=0.018mol,丙中生成氢气的物质的量为0.03mol,而0.018molMg完全反应生成0.018mol氢气,则Al参与反应生成氢气的物质的量为:0.03mol-0.018mol=0.012mol,则生成0.012mol氢气消耗Al的物质的量为:0.012mol×$\frac{2}{3}$=0.08mol,所以丙组充分反应后铝的物质的量为:0.018mol-0.08mol=0.01mol,故D正确.
故选CD.
点评 本题考查化学方程式的计算,为高频考点,题目难度中等,注意通过各组数据判断反应的程度、正确使用数据计算为解答该题的关键,试题侧重考查学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
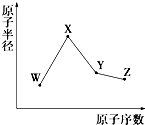 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )| A. | 对应简单离子半径:X>W | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 化合物XZW既含离子键,又含共价键,属于弱电解质 | |
| D. | Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成与氮的氧化物无关 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | 白酒中混有少量塑化剂,可通过过滤除去 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 仅①②③④ | C. | 仅①③④⑤ | D. | 仅①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
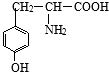 有一种结构简式如图的有机物,请回答下列问题:
有一种结构简式如图的有机物,请回答下列问题: +2NaOH→
+2NaOH→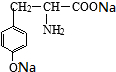 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com